а - схема сварки; б - зона сварки;
Последовательность операций точечной сварки следующая:
1. Заготовки устанавливают и затем плотно сжимают между электродами контактной машины.
2. Включают ток, и заготовки быстро нагреваются. Особенно быстро нагреваются участки металла, прилегающие к контакту между заготовками, так как эти участки имеют повышенное электрическое сопротивление. Кроме того, они менее подвержены охлаждающему действию электродов.
3. В момент образования в зоне сварки расплавленного ядра заданных размеров ток выключают.
4. После выключения тока заготовки кратковременно выдерживают между электродами под действием усилия сжатия, в результате чего происходит охлаждение зоны сварки, кристаллизация расплавленного металла и уменьшение усадочной раковины в ядре сварочной точки.
Силу тока и усилие сжатия заготовок устанавливают постоянными или изменяют по определенному графику в течение цикла сварки одной точки.
Контактная сварка отличается высокой производительностью, экономичностью процесса, позволяет значительно проще механизировать и автоматизировать процессы изготовления деталей, сокращать расход основных и вспомогательных материалов. Эти преимущества особенно заметно проявляются в массовом и крупносерийном производствах. Контактная сварка производится на специальных сварочных машинах.
|
|
|
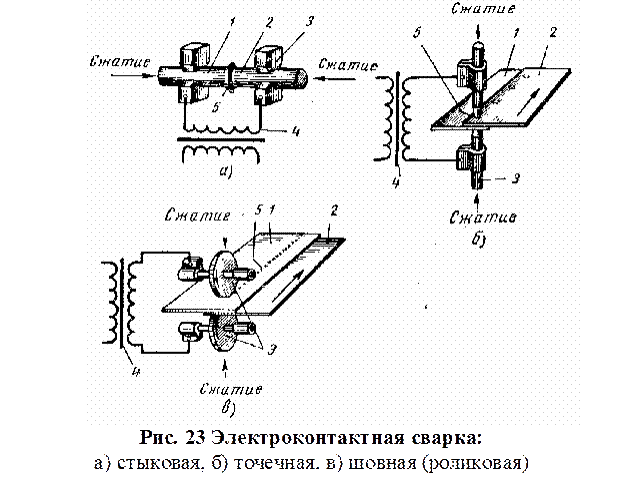
Наиболее широкое применение получили следующие основные виды контактной сварки: стыковая, точечная и шовная (рис.23).
Выбор способа контактной сварки определяется толщиной и материалом свариваемых заготовок. Точечной сваркой можно сваривать листовые заготовки одинаковой или разной толщины, пересекающиеся стержни, листовые заготовки со стержнями или профильными заготовками (уголками, швеллерами, таврами и т.п.) заготовки из разнородных металлов, из сталей различных марок (углеродистой, легированной, коррозионностойкой и др.), а также из цветных металлов и их сплавов. Толщина каждой из заготовок, соединяемых точечной сваркой, может быть от сотых долей миллиметра до 30 мм.
В зависимости от числа свариваемых точек, способа подвода тока к заготовкам и других факторов применяют различные способы точечной сварки.
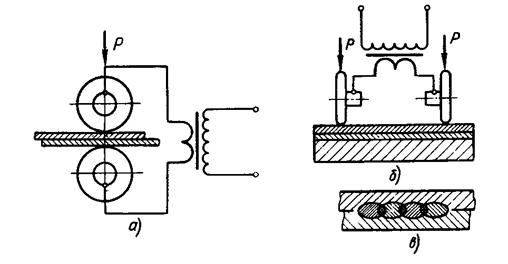
Шовная сварка (рис.23в; рис.24). Заготовки соединяют непрерывным прочноплотным швом, состоящим из ряда точек, в котором каждая последующая точка частично перекрывает предыдущую. В отличие от точечной сварки заготовки устанавливают между вращающимися роликами (или между роликами и оправкой), на которые действует усилие механизма сжатия и к которым подведен электрический ток. Толщина каждой из заготовок обычно не превышает 3 мм.
|
|
|
|
|
| Рис.24. Шовная сварка а - схема сварки между роликами; б - схема сварки между роликами и оправкой; в - зона сварки |
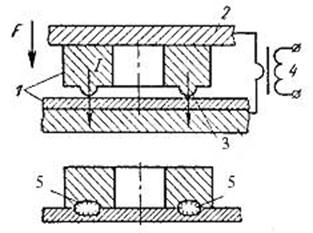
Рельефная сварка. Характерна тем, что на одной из заготовок предварительно изготовляют рельефы (выступы) круглой, кольцевой, продолговатой или иной формы (рис.25). Сварку осуществляют одновременно по всем рельефам или по всей площади соприкосновения заготовок. Рельефная сварка высокопроизводительна, применяется в массовом и крупносерийном производствах.
|
| Рис.25. Рельефная сварка: 1– свариваемые изделия; 2– электроды; 3 – рельефы; 4 – сварочный трансформатор; 5- сварные точки |
Лекция 1. Квантово-механическая модель строения атома
Ключевые слова: атом, корпускулярно-волновые свойства атомов, принцип неопределенности, квантовые числа, орбиталь, уровни и подуровни орбиталей.
Атом - химически неделимая единица вещества и представляет собой сложную электронейтральную микросистему находящихся в движении элементарных частиц. Характеристики основных элементарных частиц атома:
| Частица | протон | нейтрон | электрон |
| Масса, а.е.м. | 1,00728 | 1,00866 | 5,4858 10-4 |
| Заряд, отн. ед. | + 1 | - 1 |
В 1911г. Э.Резерфорд предложил модель атома, согласно которой атом состоит из положительно заряженного ядра, в котором находится почти вся масса атома, и располагающихся вокруг ядра электронов. Ядро состоит из протонов и нейтронов. Число электронов равно числу протонов и, поэтому, атом электронейтрален. Химический элемент - определенный вид атомов с одинаковым зарядом ядра. Атомы – наименьшие частицы химических элементов, являющихся носителями их химических свойств. Заряд ядра (сумма протонов) численно равен порядковому номеру элемента в периодической системе.В основе квантово-механической теории строения атомов лежит представление о двойственности природы электронов и других микрочастиц, то есть их корпускулярно-волновые свойства. С движущимся электроном ассоциируется волна, длина которой определяется уравнением Де-Бройля: 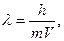 где λ - длина волны, (м); m - масса электрона; V -скорость движения частицы (≈108 м/с), h - постоянная Планка. Вторым фундаментальным принципом квантовой механики является принцип неопределенности Гейзенберга: невозможно описать с высокой степенью точности местонахождение электрона (координаты), и его энергию (импульс) в один и тот же момент времени. В квантовой механике электрон представляют как «облако отрицательного заряда», имеющее определенные размеры и форму. Уравнение Шрёдингера (1926 г) описывает волновые и корпускулярные свойства электрона в атоме водорода. Решениями уравнения Шредингера являются энергии электрона и волновая функция ψ(пси). Решения его возможны только при определенных дискретных значениях энергии электрона: Е1, Е2, … Еn. Волновая функция ψ зависит от координат (x, y, z), и энергии E электрона и не имеет определенного физического толкования. Квадрат волновой функции ψ2 определяет плотность вероятности нахождения электрона в точке с координатами (x, y, z). ψ2·ΔV –вероятность нахождения электрона в данном объеме атома ΔV. Чем больше ψ2·ΔV, тем плотнее электронное облако в данном объеме атома. Каждой волновой функции соответствует набор из трех целочисленных параметров - квантовых чисел – n, l, m l. Область пространства, в которой вероятность нахождения электрона составляет не менее 90%, называют атомной орбиталью. Атомные орбитали различаются по энергии, размерам, форме, ориентации в пространстве и могут быть охарактеризованы тремя квантовыми числами (n, l, m l).
где λ - длина волны, (м); m - масса электрона; V -скорость движения частицы (≈108 м/с), h - постоянная Планка. Вторым фундаментальным принципом квантовой механики является принцип неопределенности Гейзенберга: невозможно описать с высокой степенью точности местонахождение электрона (координаты), и его энергию (импульс) в один и тот же момент времени. В квантовой механике электрон представляют как «облако отрицательного заряда», имеющее определенные размеры и форму. Уравнение Шрёдингера (1926 г) описывает волновые и корпускулярные свойства электрона в атоме водорода. Решениями уравнения Шредингера являются энергии электрона и волновая функция ψ(пси). Решения его возможны только при определенных дискретных значениях энергии электрона: Е1, Е2, … Еn. Волновая функция ψ зависит от координат (x, y, z), и энергии E электрона и не имеет определенного физического толкования. Квадрат волновой функции ψ2 определяет плотность вероятности нахождения электрона в точке с координатами (x, y, z). ψ2·ΔV –вероятность нахождения электрона в данном объеме атома ΔV. Чем больше ψ2·ΔV, тем плотнее электронное облако в данном объеме атома. Каждой волновой функции соответствует набор из трех целочисленных параметров - квантовых чисел – n, l, m l. Область пространства, в которой вероятность нахождения электрона составляет не менее 90%, называют атомной орбиталью. Атомные орбитали различаются по энергии, размерам, форме, ориентации в пространстве и могут быть охарактеризованы тремя квантовыми числами (n, l, m l).
Главное квантовое число – n - принимает только целые положительные значения n = 1, 2, 3…∞. С увеличением n энергия и размер электронного облака (атомной орбитали) возрастает. Совокупность атомных орбиталей с одинаковым значением n называют уровнем или электронным слоем. Максимально возможное число орбиталей и электронов на уровне, соответственно равны - n2 и 2n2.
|
|
|
Орбитальное квантовое число l определяет значения орбитального момента количества движения электрона и принимает значения от 0 до (n-1), например, при n = 3: l = 0, 1, 2. Характеризует форму атомных орбиталей (электронных облаков), для которых в зависимости от l приняты соответствующие обозначения: l 0, 1, 2, 3, 4, 5…
обозначение s, p, d, f, g, h…
s - Орбиталь (s – электронное облако) имеет шарообразную форму. При l =1 зона вероятностного распределения электронов представляет собой гантелеобразное облако с центром в ядре (р-орбиталь). У d - орбитали (l = 2) и f - орбитали (l = 3) форма электронных облаков еще более сложная. Совокупность атомных орбиталей с одинаковым значением n и l называют подуровнем или электронной подоболочкой. Число возможных орбиталей и электронов в пределах подуровня, соответственно равны - (2 l +1) и 2(2 l +1).
Магнитное квантовое число - m l – может принимать положительные и отрицательные целочисленные значения от – l до + l через нуль. В зависимости от значений ml определяются возможные ориентации орбиталей одной формы и их число, которое равно количеству значений m l. Так, для s - орбиталей (l = 0, m l = 0), возможна одна ориентация, поскольку шар симметричен относительно трех осей ординат. Для р - орбиталей (l =1, ml = -1, 0, +1), что соответствует трем ориентациям р - орбиталей относительно трех осей. Для d - орбиталей (l =2, m l = -2, -1, 0, +1, +2) число возможных ориентаций – пять, для f – орбиталей - семь.
Спиновое (ms) квантовое число характеризует сложное движение электрона вокруг собственной оси; принимает значения +1/2 и –1/2.
Контрольные вопросы:
1. Как вы понимаете корпускулярно-волновые свойства атомов?
2. Что такое орбиталь? Физический смысл Ψ2? Типы орбиталей?
3. Квантовые числа, что они описывают?
4. Что такое энергетический (электронный) уровень, подуровень?
Рекомендуемая литература:
|
|
|
1. Глинка Н.Л. Общая химия: Учебное пособие для вузов / Н.Л. Глинка. - М.: КНОРУС, 2009. - с. 60 - 88.
2. Коровин Н.В. Общая химия. Учебник для технических направ. и спец. Вузов - 7-е изд., испр. - М.: Высшая школа, 2006 - с. 17 – 25.
Н.М. Шаймарданов
 2014-04-05
2014-04-05 2265
2265








