Особое место среди обменных реакций занимает гидролиз. В общем случае гидролиз (от греч. hydros – вода и lysis – разложение, распад) – это взаимодействие веществ с водой. Гидролизу могут подвергаться химические соединения различных классов: соли, углеводы, белки, эфиры, жиры и т.д. При гидролизе солей образуется основание и кислота. Например, при гидролизе цианистого натрия NaCN образуется гидроксид натрия NaOH и синильная кислота HCN:
NaCN(р.) + HOH «NaOH(р.) + HCN(р.).
Таким образом гидролиз соли обратен процессу нейтрализации (т.е. процессу взаимодействия кислот с основаниями). При гидролизе соединений неметаллов обычно образуется две кислоты. Например, при гидролизе трихлорида фосфора PCl3 образуются ортофосфористая H3PO3 и соляная HCl кислоты:
PCl3(р.) + 3HOH «H3PO3(р.) + 3HCl(р.).
В неорганической химии чаще всего рассматривают гидролиз солей. Гидролиз солей – это реакции обмена между водой и растворёнными в ней солями, происходящая в результате поляризационного взаимодействия ионов соли с их гидратной оболочкой в водном растворе. Чем значительнее это взаимодействие, тем интенсивнее протекает гидролиз. В результате гидролиза соли в растворе появляется некоторое избыточное количество ионов H+ или OH–, сообщающее раствору кислотные или щелочные свойства. Показателем глубины протекания гидролиза является степень гидролиза b – отношение концентрации гидролизованных молекул СМ(гидр.) к исходной концентрации растворённых молекул соли СМ:
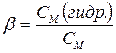 . . | (5.42) |
Степень гидролиза обычно невелика. Так, при Т = 298,15 К в растворе 0,1 М CH3COONa b» 10–4; в растворе 0,01 М NH4Cl b» 10–4; в растворе 0,1 М CH3COONH4 b» 5×10–3. Т.к. гидролиз – эндотермический процесс (DrH > 0), степень гидролиза возрастает с увеличением температуры в соответствии с принципом Ле-Шателье – Брауна (см. §3.5).
Различают 4 варианта взаимодействия воды и соли:
1. Если катионы и анионы имеют небольшие заряды и большие размеры, то их поляризующее влияние на молекулы воды невелико, т.е. взаимодействие соли с водой практически не происходит. Это относится к солям, образованным сильным основанием (катионы Na+, K+, Ca2+ и т.д.) и сильной кислотой (анионы Cl–, NO3–, SO42– и т.д.). Итак, соли, образованные сильным основанием и слабой кислотой, гидролизу не подвергаются. В этом случае равновесие диссоциации воды в присутствие ионов соли почти не нарушается. Растворы таких солей практически нейтральны (рН» 7).
2. Если соль образована катионом сильного основания и анионом слабой кислоты (S2–, CO32–, CN–, F–, CH3COO– и т.д.), то происходит гидролиз по аниону. Например, взаимодействие карбоната натрия Na2CO3 с водой:
Na2CO3(р.) + HOH «NaOH(р.) + NaHCO3(р.),
2Na+ + CO32– + HOH «Na+ + OH– + Na+ + HCO3–,
CO32– + HOH «OH– + HCO3–.
Так как в растворе образуется избыток гидроксид-ионов OH–, то раствор имеет щелочную реакцию (рН > 7). Гидролиз многоосновных анионов протекает в основном по первой ступени (как в рассмотренном примере). Второй, третьей и т.д. ступенями гидролиза обычно пренебрегают.
Запишем выражение константы равновесия КС данной реакции гидролиза по аниону, принимая, что в разбавленных растворах активности ионов примерно раны их концентрациям:
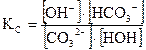 .
.
Так как концентрация воды [HOH] при гидролизе изменяется незначительно, её принимают постоянной и, умножая на константу равновесия КС, получают константу гидролиза КГ:
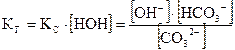 .
.
В общем виде для реакции гидролиза соли по аниону A– слабой кислоты НА:
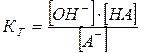 . . | (5.43) |
Если СМ – молярная концентрация гидролизуемой соли, а b – степень гидролиза, то равновесные концентрации частиц будут равны соответственно: [OH–] = [HA] = bCМ, [A–] = CМ(1 – b). Подставляя эти соотношения в уравнение (5.43), получаем:
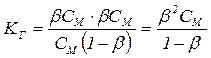 . . | (5.44) |
Т.к. b << 1, можно принять 1 – b» 1, тогда уравнение (5.44) переходит в:
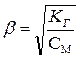 . . | (5.45) |
Из уравнения (5.45) следует, что степень гидролиза соли по аниону b возрастает с уменьшением концентрации гидролизуемой соли СМ, т.е. с разбавлением раствора соли.
Константа гидролиза соли по аниону связана с константой диссоциации слабой кислоты. В уравнении (5.43) умножим числитель и знаменатель на [H+]:
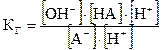 .
.
Учитывая, что [OH–]×[H+] = КВ (ионное произведение воды – см. (5.31)), а 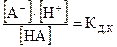 (константа диссоциации слабой кислоты НА – см. (5.13)), получим:
(константа диссоциации слабой кислоты НА – см. (5.13)), получим:
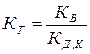 . . | (5.46) |
Заметим, что в рассмотренном примере гидролиза Na2CO3:
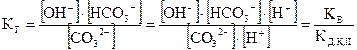 ,
,
где КД,К,II – константа диссоциации угольной кислоты по второй ступени. Таким образом, в уравнение (5.46) для расчёта константы гидролиза по первой ступени входит константа диссоциации слабого электролита по последней ступени.
3. Если соль образована катионом слабого основания (NH4+, Cu2+, Al3+ и т.д.) и анионом сильной кислоты,то происходит гидролиз по катиону. Например, взаимодействие хлорида алюминия AlCl3 с водой:
AlCl3(р.) + HOH «AlOHCl2(р.) + HCl(р.),
Al3+ + 3Cl– + HOH «AlOH2+ + 2Cl– + H+ + Cl–,
Al3+ + HOH «AlOH2+ + H+.
Так как в растворе образуется избыток гидрид-ионов H+, то раствор имеет кислую реакцию (рН < 7). Гидролиз многокислотных катионов, так же, как и многоосновных анионов, протекает в основном по первой ступени.
Запишем выражение константы равновесия данной реакции гидролиза по катиону КС:
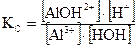 .
.
Выражение константы гидролиза КГ:
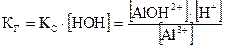 .
.
В общем виде для реакции гидролиза по катиону К+ слабого основания КОН:
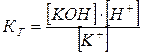 . . | (5.47) |
Для раствора гидролизуемой соли концентрацией СМ [КOH] = [H+] = bCМ, [К+] = CМ(1 – b). Подставляя эти соотношения в уравнение (5.47) при b << 1, получим выражения (5.44) и (5.45). Таким образом, степень гидролиза соли по катиону b возрастает с уменьшением концентрации гидролизуемой соли СМ, т.е. с разбавлением раствора соли.
В уравнении (5.47) умножим числитель и знаменатель на [ОH–]:
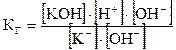 .
.
Учитывая, что [OH–]×[H+] = КВ, а 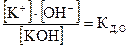 (константа диссоциации слабого основания КОН), получим выражение, аналогичное (5.46) с той разницей, что в него входит константа диссоциации не слабой кислоты НА КД,К, а слабого основания КОН КД,О:
(константа диссоциации слабого основания КОН), получим выражение, аналогичное (5.46) с той разницей, что в него входит константа диссоциации не слабой кислоты НА КД,К, а слабого основания КОН КД,О:
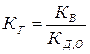 . . | (5.48) |
В рассмотренном примере гидролиза AlCl3:
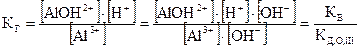 ,
,
где КД,О,III – константа диссоциации гидроксида алюминия по третьей (последней) ступени.
4. Если соль образована катионом слабого основания и анионом слабой кислоты,то происходит гидролиз по катиону и аниону. Например, взаимодействие ацетата аммония CH3COONH4 с водой:
CH3COONH4(р.) + HOH «NH4OH(р.) + CH3COOH(р.),
CH3COO– + NH4+ + HOH «NH4OH + CH3COOH.
Так как в растворе не образуется избытка ни ионов H+, ни ионов ОH–, раствор имеет реакцию близкую к нейтральной (рН» 7). Растворы солей этого типа в зависимости от соотношения констант диссоциации слабых кислоты и основания могут иметь слабокислую или слабощелочную реакцию.
Запишем выражение константы равновесия рассмотренной реакции гидролиза по катиону и аниону КС:
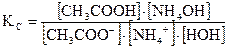 .
.
Выражение константы гидролиза КГ:
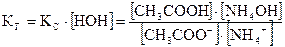 .
.
В общем виде для реакции гидролиза по катиону К+ слабого основания КОН и аниону A– слабой кислоты НА:
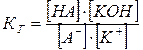 . . | (5.49) |
Для раствора гидролизуемой соли концентрацией СМ [HA] = [КOH] = bCМ; [A–] = [K+] = CМ(1 – b). Подставляя эти соотношения в уравнение (5.49), получим:
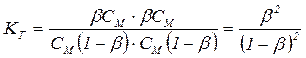 . . | (5.50) |
Т.к. b << 1, примем (1 – b)2» 1, тогда:
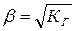 . . | (5.51) |
Из уравнения (5.51) следует, что степень гидролиза соли по катиону и аниону b не зависит от исходной концентрации соли СМ.
В уравнении (5.49) умножим числитель и знаменатель на ионное произведение воды [OH–]×[H+] = КВ:
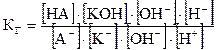 .
.
Учитывая, что константа диссоциации слабой кислоты НА 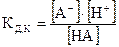 , а константа диссоциации слабого основания КОН
, а константа диссоциации слабого основания КОН 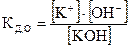 , получим:
, получим:
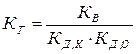 . . | (5.52) |
Из уравнений (5.46), (5.48) и (5.52) следует, что чем меньше константа диссоциации слабой кислоты КД,К, слабого основания КД,О или их произведение (КД,К × КД,О), тем больше константа гидролиза КГ. Иными словами, чем слабее кислоты и основания, тем в большей степени подвергаются гидролизу их соли.
 2015-05-26
2015-05-26 2867
2867
