 Процесс фиксации СО2 регулируется прежде всего светом (рис. 3.18), активирующим ряд ферментов цикла Кальвина: РДФ-карбоксилазу, дегидрогеназу 1,3-дифосфоглицериновой кислоты, фруктозо-1,6-дифосфатфосфатазу, седогептулозо-1,7-дифосфатфосфатазу и рибулозо-5-фосфаткиназу. Наиболее многообразна регуляция функционирования ключевого фермента цикла Кальвина — РДФ-карбоксилазы. Помимо света, фермент активируется фруктозо-6-фосфатом, а ингибируется 6-фосфоглюконатом и фруктозо-1,6-дифосфатом. 6-Фосфоглюко-нат подавляет также активность завершающего цикл фермента — рибулозо-5-фосфаткиназы. Наконец, продукт цикла фиксации СО2 — 3-фосфоглицериновая кислота — положительно влияет на синтез крахмала. Повышение концентрации О2 в строме может привести к снижению интенсивности фиксации СО2 за счет усиления фотодыхания.
Процесс фиксации СО2 регулируется прежде всего светом (рис. 3.18), активирующим ряд ферментов цикла Кальвина: РДФ-карбоксилазу, дегидрогеназу 1,3-дифосфоглицериновой кислоты, фруктозо-1,6-дифосфатфосфатазу, седогептулозо-1,7-дифосфатфосфатазу и рибулозо-5-фосфаткиназу. Наиболее многообразна регуляция функционирования ключевого фермента цикла Кальвина — РДФ-карбоксилазы. Помимо света, фермент активируется фруктозо-6-фосфатом, а ингибируется 6-фосфоглюконатом и фруктозо-1,6-дифосфатом. 6-Фосфоглюко-нат подавляет также активность завершающего цикл фермента — рибулозо-5-фосфаткиназы. Наконец, продукт цикла фиксации СО2 — 3-фосфоглицериновая кислота — положительно влияет на синтез крахмала. Повышение концентрации О2 в строме может привести к снижению интенсивности фиксации СО2 за счет усиления фотодыхания.
Функциональные изменения в клетках мезофилла. Хлоропласты большинства растений способны перемещаться в клетке в зависимости от интенсивности и направления освещения. Сильный свет вызывает отрицательный фототаксис хлоропластов: они уходят от света, концентрируясь на боковых стенках клеток палисадной паренхимы; слабый свет вызывает положительный фототаксис.

Предполагают, что освещенный хлоропласт меняет свое положение в клетке с помощью сократительных белков, связанных с оболочкой хлоропласта и взаимодействующих с сократительными белками цитоплазмы (см. рис. 13.1).
Освещенный участок листа временно приобретает электроположительный заряд, что можно обнаружить, используя внеклеточные электроды (рис. 3.19). Эта электропозитивная волна тканевого потенциала объясняется гиперполяризацией мембранного потенциала клеток мезофилла и связана с процессом фотосинтеза. У альбиносных тканей светозависимая биоэлектрическая реакция отсутствует. Имеются основания считать, что позитивация тканевого потенциала (гиперполяризация МП) есть результат активации Н+-насоса в плазмалемме клеток мезофилла. Активный транспорт ионов Н+ из цитоплазмы в клеточную стенку лежит в основе механизма поглощения веществ (см. рис. 6.8), необходимых клеткам в период высокой функциональной активности.
Мощное воздействие на клетку, определяющее ее метаболизм, оказывают образующиеся в хлоропластах АТР, NADPH и ассимиляты. При освещении отношение ATP/ADP в хлоропластах резко возрастает и вследствие быстрого обмена энергетическими эквивалентами почти тотчас же может воспроизводиться в цитоплазме, а через нее и в митохондриях. Так как оболочка хлоропласта лишь в слабой степени проницаема для АТР, перенос в цитоплазму высокоэнергетической фосфатной связи АТР осуществляется с помощью челночного механизма в результате реакции восстановления-окисления между ФГК и ФДА, так как скорость выхода триозофосфатов через мембраны оболочки хлоропласта
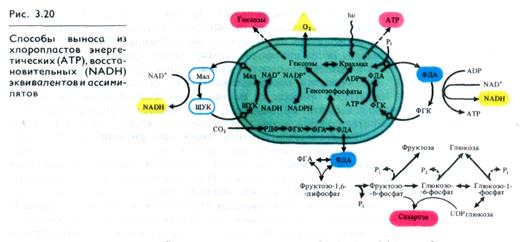
приближается к скорости свободной диффузии. Одновременно это приводит к транспорту восстановительных эквивалентов (NADH) (рис. 3.20).
Переносчиком высокого восстановительного потенциала NADPH может служить система ЩУК-малат, каждый компонент которой легко проходит через мембраны, совершая циклические перемещения между хлоропластом и цитоплазмой. В пользу этой гипотезы говорит то, что в хлоропластах находятся NAD+ - и NADP+-зависимые малатдегидрогеназы (рис. 3.20).
Появление АТР и восстановительных эквивалентов в цитоплазме приводит к активации на свету таких энергопотребляющих процессов, как синтез жирных кислот, восстановление нитратов и сульфатов. Общеклеточные нужды могут даже «отзывать» АТР с пути восстановления СО2, конкурируя с реакциями цикла Кальвина.
Уже в первые секунды фотосинтеза происходит выход ассимилятов в цитоплазму. После кратковременного фотосинтеза с 14СО2 в цитоплазме прежде всего появляются меченые фосфотриозы — ФГК и ФДА, а затем [14С] фруктозо-1,6-дифосфат. На изолированных хлоропластах показано, что оболочка хлоропласта практически непроницаема для сахарозы. По-видимому, основным местом синтеза сахарозы в клетке является не хлоропласт, а цитоплазма. На это указывает также присутствие основного сахарозосинтезирующего фермента сахарозофосфатсинтетазы и UDP-глюкозопирофосфори-лазы преимущественно в цитоплазме.
Выход предшественников углеводов из хлоропластов в цитоплазму совершается в виде ФГК, ФГА и ФДА (рис. 3.20). Дальнейшие превращения, ведущие к синтезу гексозофосфатов и сахарозы, происходят уже в цитоплазме. Аналогичным превращениям могут подвергаться триозофосфаты и в хлоропластах, вследствие чего при достаточно интенсивном фотосинтезе в хлоропластах накапливается крахмал, служащий резервом углеводов, предназначенных для экспорта в цитоплазму во вторую очередь. Отложения крахмала часто бывают очень значительными (до 90% от объема хлоропласта).
Выходящие из хлоропластов ассимиляты могут использоваться в самой фотосинтезирующей клетке двумя путями: 1) в окислительно-восстановительных процессах, что обычно заканчивается освобождением СО2, 2) для увеличения массы клетки в процессе ее роста и отложения запасных и вторичных веществ. Большая часть ассимилятов транспортируется из фотосинтезирующих клеток листа в другие органы и ткани.
Взаимодействие тканей листа при фотосинтезе. Под действием света изменения происходят не только в клетках мезофилла. Свет выступает одним из важнейших факторов регуляции работы устьиц. При включении света у большинства растений устьица открываются более широко, а при выключении — закрываются. Исключение из правила — растения семейства толстянковых, у которых ночью устьица открыты, а днем закрыты. На движения устьиц влияет и концентрация СО2: ширина устьичных щелей увеличивается при снижении содержания СО2 в межклетниках. Открывание устьиц под действием света связано с работой фотосинтетического аппарата в замыкающих клетках. У этиолированных растений свет не влияет на движения устьиц. В замыкающих клетках на свету включается механизм Н +-насоса в плазмалемме, усиливается поглощение К+ и синтез малата, в результате чего возрастает внутриклеточное осмотическое давление и устьица открываются. Более подробно этот процесс описан в разделе 13.6.1.
Увеличение степени открывания устьиц приводит к усилению транспирации и, следовательно, к более интенсивному поступлению воды и веществ по ксилеме из корней в листья, что необходимо для нормальной функциональной активности клеток мезофилла.
Фотосинтетическая деятельность клеток мезофилла обогащает ткани листа сахарами и другими продуктами фотосинтеза. В результате возрастает функциональная активность проводящих пучков. Теоретически существуют два способа транспорта ассимилятов к проводящим пучкам: по симпласту (через плазмодесмы и цитоплазму последовательного ряда клеток) и по апопласту (по клеточным стенкам). Однако у многих видов растений между клетками мезофилла и флоэмы плазмодесмы развиты крайне слабо или совсем отсутствуют. В апопласте листовой пластинки может находиться около 1/5 Сахаров, содержащихся в листе, и значительная доля свободных аминокислот. Клетки листовой паренхимы сравнительно легко выделяют ассимиляты в наружную среду и относительно слабо их поглощают. Клетки флоэмных окончаний, напротив, способны усиленно поглощать из внешних растворов сахара и аминокислоты против концентрационного градиента с помощью энергозависимых переносчиков. Есть основание считать, что, выходя из паренхимных клеток листа в клеточные стенки, сахароза расщепляется находящейся там инвертазой на гексозы (фруктозу и глюкозу), которые в проводящих пучках вновь образуют сахарозу.
Флоэмные окончания выполняют в листе роль коллекторов, аккумулирующих ассимиляты против градиента концентрации. Ведущая роль в загрузке проводящих элементов ассимилятами принадлежит сопровождающим и паренхимным клеткам флоэмы, а у некоторых видов растений и более специализированным передаточным клеткам. Есть данные о том, что клетки флоэмных окончаний поглощают сахара с участием ионов Н+, которые выкачиваются из клеток благодаря работе энергозависимого Н+-насоса (см. рис. 8.1).
При перегрузке тканей листа ассимилятами интенсивность фотосинтеза снижается. Переполнение крахмалом пластид вызывает обратимые, а позднее и необратимые изменения структуры хлоропластов, что значительно ослабляет фотосинтез. Отрицательное действие избытка крахмала на фотосинтез в пластидах может быть объяснено: 1) механическим воздействием на тилакоиды, 2) ухудшением светового режима в хлоропласте, 3) сорбцией ферментов на зернах крахмала, 4) сорбцией ионов, особенно Mg2+, необходимых для поддержания высокой активности ферментов, 5) ухудшением диффузии СО2.
 Листья большинства растений способны медленно поворачиваться к свету таким образом, чтобы обеспечить наилучшие условия для фотосинтеза. Так возникает «листовая мозаика». Это происходит за счет роста растяжением клеток в черешке или работы тургорных механизмов в листовых сочленениях (см. 13.5.2; 13.5.3).
Листья большинства растений способны медленно поворачиваться к свету таким образом, чтобы обеспечить наилучшие условия для фотосинтеза. Так возникает «листовая мозаика». Это происходит за счет роста растяжением клеток в черешке или работы тургорных механизмов в листовых сочленениях (см. 13.5.2; 13.5.3).
Реализация фотосинтетической функции в целом растении, с одной стороны, определяется значительной генетической и биохимической автономностью структур низших порядков, (хлоропласт, клетка), а с другой — сложной системой интеграции и кооперативных связей фотосинтеза со всеми функциями растительного организма. Процессы онтогенеза обеспечивают постоянное существование в растительном организме так называемых аттрагирующих (притягивающих питательные вещества) зон. В аттрагирующих центрах происходит либо новообразование и рост структур, либо интенсивный однонаправленный синтез запасных веществ (плоды, клубни, луковицы). В обоих случаях состояние аттрагирующих центров определяет величину «запроса» на фотосинтез. Донор асси-милятов (фотосинтез) и их акцептор (процессы роста и отложения веществ в запас) представляют собой взаимосвязанную систему. Если внешние условия не лимитируют фотосинтез, то ведущая роль в его детерминации принадлежит именно эпигенетическим процессам (появлению и развитию новых органов). Это положение может быть проиллюстрировано многочисленными фактами. Так, удаление молодых початков у кукурузы, црюдов у томатов, баклажанов или яблони вызывает значительное и устойчивое снижение фотосинтетической активности листьев. Удаление части листьев растения при сохранении прежней активности аттрагирующих центров обычно сопровождается увеличением фотосинтетической активности оставшихся листьев.
Механизм этих взаимоотношений основан на явлении метаболической репрессии фотосинтеза. Чем мощнее центры, ат-трагирующие ассимиляты, тем эффективнее фотосинтезирующий лист освобождается от ассимилятов, что служит необходимым условием интенсивного фотосинтеза.
Во всех этих процессах важнейшую роль играют фитогормоны и эндогенные ингибиторы роста и метаболизма (некоторые полифенолы). Участие фитогормонов в процессах фотосинтеза можно представить в виде следующей схемы, предложенной А. Т. Мокроносовым (1983):
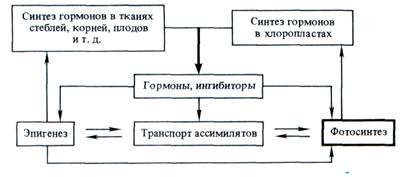 |
Согласно этой схеме, фитогормоны образуются в разных частях растений, в том числе в хлоропластах, и действуют на процессы фотосинтеза как дистанционно, так и непосредственно на уровне хлоропластов. Дистанционное действие осуществляется благодаря регулирующему влиянию фитогормонов на процессы роста и развития (эпигенез), на отложение веществ в запас, на транспорт ассимилятов, т. е. на формирование и активность аттрагирующих центров. С другой стороны фитогормоны оказывают прямое действие на функциональную активность хлоропластов через изменение состояния мембран, активность ферментов, генерацию трансмембранного потенциала. Доказана также роль фитогормонов, в частности цитокинина, в биогенезе хлоропластов, синтезе хлорофилла и ферментов цикла Кальвина.
 |
Ряд фитогормонов (индолилуксусная кислота, гиббереллины, абсцизовая кислота), а также некоторые физиологически активные фенолы образуются в тканях листа. Цитокинин же, от которого во многом зависит формирование листа и его структур, поступает из других частей растения, прежде всего из корня. Такая система создает взаимозависимость всех органов, обеспечивая регуляцию функциональной активности в целом растении.
 Под экологией фотосинтеза понимают зависимость продук тивности фотосинтеза от факторов внешней среды: интен сивности и качества света, концентрации СО2, температуры, водного режима тканей листа, минерального питания и др. Влияние этих факторов и адаптация к ним растений очень существенны для растениеводства.
Под экологией фотосинтеза понимают зависимость продук тивности фотосинтеза от факторов внешней среды: интен сивности и качества света, концентрации СО2, температуры, водного режима тканей листа, минерального питания и др. Влияние этих факторов и адаптация к ним растений очень существенны для растениеводства.
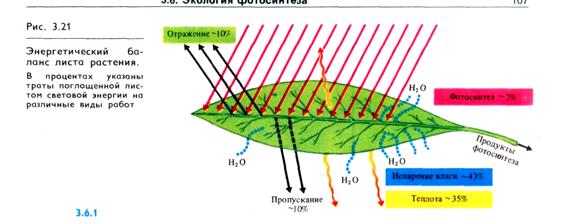 |
Интенсивность и спектральный состав света. В среднем листья поглощают 80 — 85% энергии фотосинтетически активных лучей солнечного спектра (400 — 700 нм) и 25% энергии инфракрасных лучей, что составляет около 55% от энергии общей радиации. На фотосинтез расходуется 1,5 — 2% поглощенной энергии (фотосинтетически активная радиация — ФАР) (рис. 3.21).
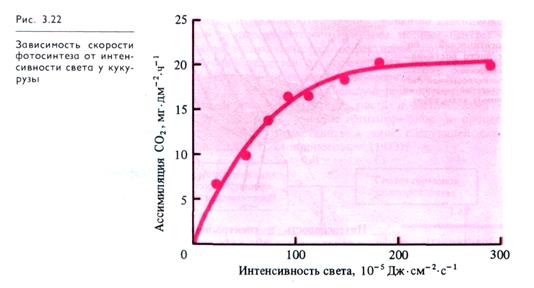
Зависимость скорости фотосинтеза от интенсивности света имеет форму логарифмической кривой (рис. 3.22). Прямая зависимость скорости процесса от притока энергии наблюдается только при низких интенсивностях света. Фотосинтез начинается при очень слабом освещении. Впервые это было показано А. С. Фаминцыным в 1880 г. на установке с искусственным освещением. Света керосиновой лампы оказалось достаточно для начала фотосинтеза и образования крахмала в растительных клетках. У многих светолюбивых растений максимальная (100%) интенсивность фотосинтеза наблюдается при освещенности, достигающей половины от полной солнечной, которая, таким образом, является насыщающей. Дальнейшее возрастание освещенности не увеличивает фотосинтез и затем снижает его.
Анализ световых кривых фотосинтеза позволяет получить информацию о характере работы фотохимических систем и ферментативного аппарата. Угол наклона кривой характеризует скорость фотохимических реакций и содержание хлорофилла: чем он больше, тем активнее используется световая энергия. Обычно больше он у теневыносливых растений, обитающих под пологом леса, и у глубоководных водорослей. У этих растений, приспособленных к условиям слабого освещения, хорошо развитый пигментный аппарат позволяет активнее использовать низкие интенсивности света.
Активность фотосинтеза в области насыщающей интенсивности света характеризует мощность систем поглощения и восстановления СО2 и определяется концентрацией СО2. Чем выше кривая в области насыщения интенсивности света, тем мощнее аппарат поглощения и восстановления СО2. У светолюбивых растений насыщение достигается при значительно
большей освещенности, чем у теневыносливых. Например, у теневыносливого печеночного мха маршанции световое насыщение фотосинтеза достигается при 1000 лк, у светолюбивых древесных растений — при 10 — 40 тыс. лк, а у некоторых высокогорных растений Памира (где освещенность достигает максимальных на Земле значений порядка 180 тыс. лк) — при 60 тыс. лк и выше. Светолюбивы большинство сельскохозяйственных и древесных растений, а также водоросли мелководий.
У растений, осуществляющих С3-путь фотосинтеза, насыщение происходит при более низкой интенсивности света, чем у растений с С4-путем превращения углерода, высокая фото-синтезирующая активность которых проявляется только при высоком уровне освещенности.
В области светового насыщения интенсивность фотосинтеза значительно выше интенсивности дыхания. При снижении освещенности до определенной величины интенсивности фотосинтеза и дыхания уравниваются. Уровень освещения, при котором поглощение СО2 в процессе фотосинтеза уравновешивается выделением СО2 в процессе дыхания, называется световым компенсационным пунктом. Его величину определяют при 0,03% СО2 и температуре 20 °С. Значение светового компенсационного пункта неодинаково не только у теневыносливых (составляет примерно 1 % от полного света) и светолюбивых растений (около 3 — 5% от полного солнечного света), но и у листьев разных ярусов одного и того же растения, оно зависит также от концентрации СО2 в воздухе. Чрезмерно высокое освещение резко нарушает процесс биосинтеза пигментов, фотосинтетические реакции и ростовые процессы, что в итоге снижает общую продуктивность растений.
Существенно, что даже кратковременное изменение условий
освещенности влияет на интенсивность фотосинтеза. Это важное адаптационное свойство позволяет растениям в фитоценозах полнее использовать свет. Фотосинтетический аппарат «настраивается» на периодические сдвиги освещенности при ветре, на частоту мелькания бликов в доли секунды.
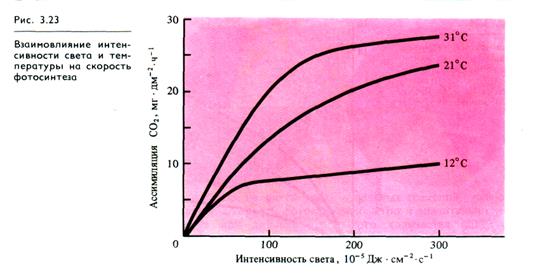
На ход световых кривых фотосинтеза влияют изменения других факторов внешней среды. Например, при низких температурах (12 °С) повышение интенсивности света становится малоэффективным (рис. 3.23). Температурный оптимум у растений с С3-типом фотосинтеза лежит в пределах 25 — 35 °С. Повышение концентрации СО2 с увеличением освещенности приводит к возрастанию скорости фотосинтеза (рис. 3.24).
Помимо интенсивности для процесса фотосинтеза важен и качественный состав света. Скорость фотосинтеза в разных участках спектра, выравненных по количеству энергии, не одна и та же. Наиболее высока интенсивность фотосинтеза в красных лучах.
Почему именно красные лучи наиболее эффективны для фотосинтеза? Во-первых, потому, что энергия 1 кванта красного света (176 кДж/моль = 42 ккал/моль) вполне достаточна для перехода молекулы хлорофилла на первый синглетный уровень возбуждения S*i (см. рис. 3.4). Затем эта энергия целиком может быть использована на фотохимические реакции. Энергия же 1 кванта синего света выше (293 кДж/моль=70 ккал/моль). Поглотив квант синего света, молекула хлорофилла переходит на более высокий уровень синглетного возбуждения 5*, и эта излишняя энергия превращается в теплоту при переходе молекулы в состояние S*1 Энергия 1 кванта красного света примерно эквивалентна энергии перехода окислительно-восстановительного потенциала системы от е' 0 = +0,8 В до Е'0 = -0,8 В (см. рис. 3.10). Энергия 1 кванта инфракрасных лучей уже недостаточна для фотоокисления воды,но у фотосинтезирующих серных бактерий эта энергия вполне обеспечивает фотоокисление H2S в процессе фоторедукции. Поэтому у серных бактерий фотосинтез с участием бак-териохлорофилла осуществляется при действии невидимого для человеческого глаза инфракрасного света.
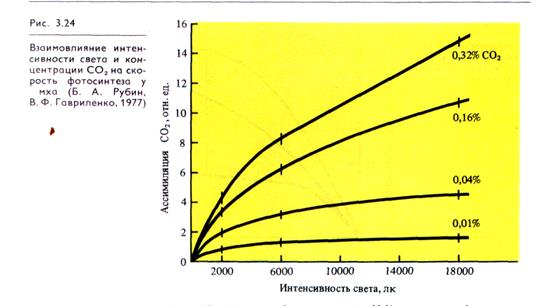
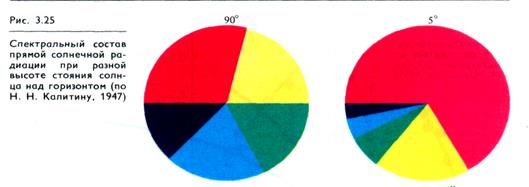
Во-вторых, красный свет всегда присутствует в лучах прямой солнечной радиации. Если солнце находится под углом 90 °, то красные лучи составляют примерно 1/4 часть полного солнечного света. Если же солнце стоит низко, красные лучи становятся преобладающими. При стоянии солнца под углом 5 ° красный свет составляет 2/3 от полного (рис. 3.25).
Растения, выращенные на синем и красном свету, существенно различаются по составу продуктов фотосинтеза. По данным Н. П. Воскресенской (1965), при выравнивании синего и красного света по квантам, т. е. при одинаковых для фотохимической стадии фотосинтеза условиях освещения, синий свет уже через несколько секунд экспозиции активирует включение 14С в неуглеводные продукты — амино- и органические кислоты, главным образом в аланин, аспартат, малат, цитрат, и в более поздние сроки (через минуты) — во фракцию белков, а красный свет при коротких экспозициях — во фракцию растворимых углеводов и при минутных экспозициях — в крахмал. Таким образом, на синем свету по сравнению с красным светом в листьях дополнительно образуются неуглеводные продукты. Эти различия в метаболизме углерода при действии света разного качества обнаружены у целых растений с С3 и С4-путями ассимиляции СО2, у зеленых и красных водорослей; они сохраняются при различных концентрациях СО2 и неодинаковой интенсивности света. Но у изолированных хлоропластов различий в образовании крахмала на синем и красном свету не обнаружено. Полагают, что фоторецептором, с деятельностью которого связаны изменения в метабо-
лизме углерода на синем свету у зеленых растений, являются флавины. Скорость фотосинтеза быстро и значительно увеличивается при добавке небольшого количества (20% от насыщения красного света) синего света к красному. По-видимому, это связано с тем, что фотохимическая стадия фотосинтеза регулируется синим светом.
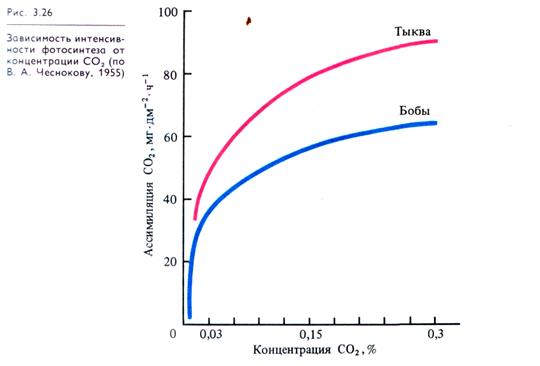
Концентрация диоксида углерода. СО2 является основным субстратом фотосинтеза; его содержание определяет интенсивность процесса. Концентрация СО2 в атмосфере составляет 0,03%. В слое воздуха высотой 100 м над гектаром пашни содержится 550 кг СО2. Из этого количества за сутки растения поглощают 120 кг СО2. Зависимость фотосинтеза от СО2 выражается логарифмической кривой (рис. 3.26). При концентрации 0,03 % интенсивность фотосинтеза составляет лишь 50 % от максимальной, которая достигается при 0,3% СО2. Это свидетельствует о том, что в эволюции процесс фотосинтеза формировался при большей концентрации СО2 в атмосфере. Кроме того, такой ход зависимости продуктивности фотосинтеза от концентрации СО2 указывает на возможность подкормки растений в закрытых помещениях СО2 для получения большего урожая. Такая подкормка СО2 оказывает сильное влияние на урожай растений с C3-типом ассимиляции СО2 и не влияет на растения с С4-типом, у которых существует особый механизм концентрирования СО2 (см. рис. 3.14).
Интенсивность ассимиляции СО2 зависит от скорости его поступления из атмосферы в хлоропласта, которая определяется скоростью диффузии СО2 через устьица, межклетники и в цитоплазме клеток мезофилла листа. В открытом состоянии устьица занимают лишь 1—2% площади листа, остальная поверхность покрыта плохо проницаемой для газов кутикулой. Однако при наличии кутикулы СО2 входит в лист через устьица за единицу времени в таком же количестве, как и без нее. Объясняется это законом Стефана, согласно которому скорость перемещения молекул газа через малые отверстия пропорциональна их окружности, а не площади. Чем меньше отверстие, тем больше отношение окружности к площади. А у края отверстия молекулы в меньшей степени сталкиваются друг с другом и быстрее диффундируют. Поэтому, через устьице с апертурой (открытостью)
порядка 10 мкм молекулы газа перемещаются с большой скоростью. На процессы открывания и закрывания устьиц влияют СО2, насыщенность тканей водой, свет, фитогормоны (см. 13.6.1).
Температура. Первичные фотофизические процессы фотосинтеза (поглощение и миграция энергии, возбужденные состояния) не зависят от температуры. Очень чувствительны к температуре процессы фотосинтетического фосфорилирования. Скорость комплекса энзиматических реакций, сопряженных с восстановлением углерода, при повышении температуры на 10°С возрастает в 2 — 3 раза (Q10 = 2 —3).
Общая зависимость фотосинтеза от температуры выражается одновершинной кривой (рис. 3.27). Кривая имеет три основные (кардинальные) температурные точки: минимальную, при которой начинается фотосинтез, оптимальную и максимальную. Интенсивность фотосинтеза при супероптимальных температурах зависит от продолжительности их воздействия на растения. Нижняя температурная граница фотосинтеза у растений северных широт находится в пределах — 15°С (сосна, ель)... —0,5 °С, а у тропических'растений — в зоне низких положительных температур 4 — 8 °С. У растений умеренного пояса в интервале 20 — 25 °С достигается максимальная интенсивность фотосинтеза, а дальнейшее повышение температуры до 40 °С приводит к быстрому ингибированию процесса (при 45 °С растения погибают). Некоторые растения пустынь способны осуществлять фотосинтез при 58 °С. Температурные границы
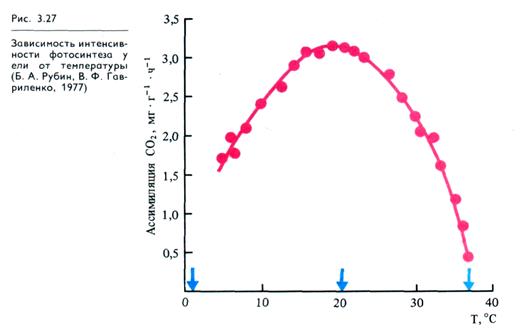
фотосинтеза можно раздвинуть предварительным закаливанием, адаптацией растений к градиенту температур. Наиболее чувствительны к действию температуры реакции кар-боксилирования, превращения фруктозо-6-фосфата в сахарозу и крахмал, а также транспорт сахарозы из листьев в другие органы.
Необходимо отметить, что влияние на фотосинтез света, концентрации СО2 и температуры осуществляется в сложном взаимодействии. Особенно тесно взаимосвязаны свет, действующий на скорость фотохимических реакций, и температура, контролирующая скорость энзиматических реакций. В условиях высокой интенсивности света и низких температур (5— 10 °С), когда главным фактором, лимитирующим скорость всего процесса, являются ферментативные реакции, контролируемые температурой, значения Q10 могут быть > 4. При более высоких температурах Q10 снижается до 2. При низких ин-тенсивностях света Q10 = 1, т. е. фотосинтез относительно независим от температуры, так как его скорость в данном случае ограничивается фотохимическими реакциями.
Водный режим. Вода непосредственно участвует в фотосинтезе как субстрат окисления и источник кислорода. Другой аспект влияния содержания воды на фотосинтез состоит в том, что величина оводненности листьев определяет степень открывания устьиц и, следовательно, поступления СО2" лист. При полном насыщении листа водой устьица закрываются, что снижает интенсивность фотосинтеза. В условиях засухи чрезмерная потеря воды листом также вызывает закрывание устьиц под влиянием увеличения содержания в листьях
абсцизовой кислоты в ответ на недостаток влаги. Длительный водный дефицит в тканях листа при засухе приводит к ингибированию нециклического и циклического транспорта электронов и фотофосфорилирования и к снижению величины отношения ATP/NADPH за счет большего торможения образования АТР. Максимальный фотосинтез наблюдается при небольшом водном дефиците листа (порядка 5 — 20% от полного насыщения) при открытых устьицах.
Минеральное питание. Для нормального функционирования фотосинтетического аппарата растение должно быть обеспечено всем комплексом макро- и микроэлементов. Два основных процесса питания растительного организма — воздушный и корневой — тесно взаимосвязаны. Зависимость фотосинтеза от элементов минерального питания определяется их необходимостью для формирования фотосинтетического аппарата (пигментов, компонентов электронтранспортной цепи, каталитических систем хлоропластов, структурных и транспортных белков), а также для его обновления и функционирования.
Магний входит в состав хлорофиллов, участвует в деятельности сопрягающих белков при синтезе АТР, влияет на активность реакций карбоксилирования и восстановления NADP+. Вследствие этого его недостаток нарушает процесс фотосинтеза.
Железо в восстановленной форме необходимо для процессов биосинтеза хлорофилла и железосодержащих соединений хлоропластов (цитохромов, ферредоксина). Дефицит железа резко нарушает функционирование циклического и нециклического фотофосфорилирования, синтез пигментов и изменяет структуру хлоропластов.
Необходимость марганца для зеленых растений связана с его ролью в фотоокислении воды. Поэтому недостаточность питания по марганцу отрицательно сказывается на интенсивности фотосинтеза. В реакциях фотоокисления воды необходим также хлор.
Медь входит в состав пластоцианина, поэтому у растений дефицит меди вызывает снижение интенсивности фотосинтеза.
Недостаток азота сильно сказывается на формировании пигментных систем, структур хлоропласта и его общей активности. Концентрация азота определяет количество и активность РДФ-карбоксилазы.
В условиях недостатка фосфора нарушаются фотохимические и темновые реакции фотосинтеза. Особенно резко дефицит фосфора проявляется при высокой интенсивности света, при этом более чувствительными оказываются темновые реакции. Однако при уменьшении содержания фосфора в два раза интенсивность фотосинтеза снижается в меньшей степени, чем ростовые процессы и общая продуктивность растений. Избыток фосфора также тормозит скорость фотосинтеза, по-видимому, вследствие изменения проницаемости мембран.
Уменьшение содержания калия в тканях сопровождается значительным снижением интенсивности фотосинтеза и нарушениями других процессов в растении. В хлоропластах разрушается структура гран, устьица слабо открываются на свету и недостаточно закрываются в темноте, ухудшается водный режим листа, нарушаются все процессы фотосинтеза. Это свидетельствует о полифункциональной роли калия в ионной регуляции фотосинтеза.
Кислород. Процесс фотосинтеза обычно осуществляется в аэробных условиях при концентрации кислорода 21%. Увеличение содержания или отсутствие кислорода для фотосинтеза неблагоприятны.
 2015-05-26
2015-05-26 2705
2705
