Это способность материала образовывать неразъемные соединения требуемого качества. Оценивается по качеству сварного шва.
^ 4. Способность к обработке резанием.
Характеризует способность материала поддаваться обработке различным режущим инструментом. Оценивается по стойкости инструмента и по качеству поверхностного слоя.
Эксплуатационные свойства характеризуют способность материала работать в конкретных условиях.
Износостойкость – способность материала сопротивляться поверхностному разрушению под действием внешнего трения.
Коррозионная стойкость – способность материала сопротивляться действию агрессивных кислотных, щелочных сред.
Жаростойкость – это способность материала сопротивляться окислению в газовой среде при высокой температуре.
Жаропрочность – это способность материала сохранять свои свойства при высоких температурах.
Хладостойкость – способность материала сохранять пластические свойства при отрицательных температурах.
Антифрикционность – способность материала прирабатываться к другому материалу.
Эти свойства определяются специальными испытаниями в зависимости от условий работы изделий.
При выборе материала для создания конструкции необходимо полностью учитывать механические, технологические и эксплуатационные свойства.
 ^ Примеры технологических проб и их назначение.
^ Примеры технологических проб и их назначение.
Технологические пробы - это вид испытаний для выявления способности материалов принимать определённые деформации, аналогичные тем, которые претерпевают при обработке или в условиях эксплуатации.
Рассмотрим некоторые технологические пробы.
^ Технологические испытания на изгиб лент, полос, листов, сортового проката, поковок и отливок применяются для определения способности металла выдержать заданную пластическую деформацию, характеризуемую углом изгиба.
^ Проба на осадку служит для определения способности металла выдержать заданную пластическую деформацию сжатия и для выявления дефектов поверхности изделий.
^ Проба на искру позволяет приближённо судить о химическом составе стали. При обработке сталей на абразивных кругах получается мелкая стружка, которая, сгорая на воздухе, даёт сноп искр, отличающихся по форме и цвету. Углеродистые стали дают белый пучок искр; присутствие в стали вольфрама определяют по красному цвету искр, хрома -- по оранжевому….

Лекция 4 ^ Основные равновесные диаграммы состояния двойных сплавов. Связь между составом, строением и свойствами сплавов. Понятие о сплавах и методах их получения Под сплавом понимают вещество, полученное сплавлением двух или более элементов. Возможны другие способы приготовления сплавов: спекания, электролиз, возгонка. В этом случае вещества называются псевдосплавами. Сплав, приготовленный преимущественно из металлических элементов и обладающий металлическими свойствами, называется металлическим сплавом. Сплавы обладают более разнообразным комплексом свойств, которые изменяются в зависимости от состава и метода обработки. Основные понятия в теории сплавов.Система – группа металлов, выделяемых для наблюдения и изучения. В металловедении системами являются металлы и металлические сплавы. Чистый металл является простой однокомпонентной системой, сплав – сложной системой, состоящей из двух и более компонентов. Компоненты – вещества, образующие систему. В качестве компонентов выступают чистые вещества и химические соединения, если они не диссоциируют на составные части в исследуемом интервале температур. Фаза – однородная часть системы, отделенная от других частей системы поверхностного раздела, при переходе через которую структура и свойства резко меняются. Вариантность (C) (число степеней свободы) – это число внутренних и внешних факторов (температура, давление, концентрация), которые можно изменять без изменения количества фаз в системе. Если вариантность C = 1 (моновариантная система), то возможно изменение одного из факторов в некоторых пределах, без изменения числа фаз. Если вариантность C = 0 (нонвариантная cистема), то внешние факторы изменять нельзя без изменения числа фаз в оистеме Существует математическая связь между числом компонентов (К), числом фаз (Ф) и вариантностью системы (С). Это правило фаз или закон Гиббса 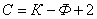 Если принять, что все превращения происходят при постоянном давлении, то число переменных уменьшится Если принять, что все превращения происходят при постоянном давлении, то число переменных уменьшится 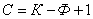 где: С – число степеней свободы, К – число компонентов, Ф – число фаз, 1 – учитывает возможность изменения температуры. ^ Особенности строения, кристаллизации и свойств сплавов: механических смесей, твердых растворов, химических соединений Строение металлического сплава зависит от того, в какие взаимодействия вступают компоненты, составляющие сплав. Почти все металлы в жидком состоянии растворяются друг в друге в любых соотношениях. При образовании сплавов в процессе их затвердевании возможно различное взаимодействие компонентов. В зависимости от характера взаимодействия компонентов различают сплавы: где: С – число степеней свободы, К – число компонентов, Ф – число фаз, 1 – учитывает возможность изменения температуры. ^ Особенности строения, кристаллизации и свойств сплавов: механических смесей, твердых растворов, химических соединений Строение металлического сплава зависит от того, в какие взаимодействия вступают компоненты, составляющие сплав. Почти все металлы в жидком состоянии растворяются друг в друге в любых соотношениях. При образовании сплавов в процессе их затвердевании возможно различное взаимодействие компонентов. В зависимости от характера взаимодействия компонентов различают сплавы:
 Рис. 4.1. Схема микроструктуры механической смеси --Сплавы химические соединения образуются между элементами, значительно различающимися по строению и свойствам, если сила взаимодействия между разнородными атомами больше, чем между однородными. ^ Особенности этих сплавов: Рис. 4.1. Схема микроструктуры механической смеси --Сплавы химические соединения образуются между элементами, значительно различающимися по строению и свойствам, если сила взаимодействия между разнородными атомами больше, чем между однородными. ^ Особенности этих сплавов:
 Рис. 4.2. Кристаллическая решетка химического соединения --Сплавы твердые растворы – это твердые фазы, в которых соотношения между компонентов могут изменяться. Являются кристаллическими веществами. Характерной особенностью твердых растворов является: наличие в их кристаллической решетке разнородных атомов, при сохранении типа решетки растворителя. Твердый раствор состоит из однородных зерен (рис. 4.3). Рис. 4.2. Кристаллическая решетка химического соединения --Сплавы твердые растворы – это твердые фазы, в которых соотношения между компонентов могут изменяться. Являются кристаллическими веществами. Характерной особенностью твердых растворов является: наличие в их кристаллической решетке разнородных атомов, при сохранении типа решетки растворителя. Твердый раствор состоит из однородных зерен (рис. 4.3).  Рис.4.3. Схема микроструктуры твердого раствора Классификация сплавов твердых растворов. По степеням растворимости компонентов различают твердые растворы: Рис.4.3. Схема микроструктуры твердого раствора Классификация сплавов твердых растворов. По степеням растворимости компонентов различают твердые растворы:
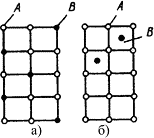 Рис.4.4. Кристаллическая решетка твердых растворов замещения (а), внедрения (б) При образовании растворов замещения периоды решетки изменяются в зависимости от разности атомных диаметров растворенного элемента и растворителя. Если атом растворенного элемента больше атома растворителя, то элементарные ячейки увеличиваются, если меньше – сокращаются. В первом приближении это изменение пропорционально концентрации растворенного компонента. Изменение параметров решетки при образовании твердых растворов – важный момент, определяющий изменение свойств. Уменьшение параметра ведет к большему упрочнению, чем его увеличение. Твердые растворы внедрения образуются внедрением атомов растворенного компонента в поры кристаллической решетки растворителя (рис. 4.4 б). Образование таких растворов, возможно, если атомы растворенного элемента имеют малые размеры. Такими являются элементы, находящиеся в начале периодической системы Менделеева, углерод, водород, азот, бор. Размеры атомов превышают размеры межатомных промежутков в кристаллической решетке металла, это вызывает искажение решетки и в ней возникают напряжения. Концентрация таких растворов не превышает 2-2.5% Твердые растворы вычитания или растворы с дефектной решеткой. образуются на базе химических соединений, при этом возможна не только замена одних атомов в узлах кристаллической решетки другими, но и образование пустых, не занятых атомами, узлов в решетке. К химическому соединению добавляют, один из входящих в формулу элементов, его атомы занимают нормальное положение в решетке соединения, а места атомов другого элемента остаются, незанятыми. ^ Кристаллизация сплавов. Кристаллизация сплавов подчиняется тем же закономерностям, что и кристаллизация чистых металлов. Необходимым условием является стремление системы в состояние с минимумом свободной энергии. Основным отличием является большая роль диффузионных процессов, между жидкостью и кристаллизующейся фазой. Эти процессы необходимы для перераспределения разнородных атомов, равномерно распределенных в жидкой фазе. В сплавах в твердых состояниях, имеют место процессы перекристаллизации, обусловленные аллотропическими превращениями компонентов сплава, распадом твердых растворов, выделением из твердых растворов вторичных фаз, когда растворимость компонентов в твердом состоянии меняется с изменением температуры. Эти превращения называют фазовыми превращениями в твердом состоянии. При перекристаллизации в твердом состоянии образуются центры кристаллизации и происходит их рост. Обычно центры кристаллизации возникают по границам зерен старой фазы, где решетка имеет наиболее дефектное строение, и где имеются примеси, которые могут стать центрами новых кристаллов. У старой и новой фазы, в течение некоторого времени, имеются общие плоскости. Такая связь решеток называется когерентной связью. В случае различия строения старой и новой фаз превращение протекает с образованием промежуточных фаз. Нарушение когерентности и обособления кристаллов наступает, когда они приобретут определенные размеры. Процессы кристаллизации сплавов изучаются по диаграммам состояния. ^ Диаграмма состояния. Диаграмма состояния представляетсобой графическое изображение состояния любого сплава изучаемой системы в зависимости от концентрации и температуры (рис. 4.5). Рис.4.4. Кристаллическая решетка твердых растворов замещения (а), внедрения (б) При образовании растворов замещения периоды решетки изменяются в зависимости от разности атомных диаметров растворенного элемента и растворителя. Если атом растворенного элемента больше атома растворителя, то элементарные ячейки увеличиваются, если меньше – сокращаются. В первом приближении это изменение пропорционально концентрации растворенного компонента. Изменение параметров решетки при образовании твердых растворов – важный момент, определяющий изменение свойств. Уменьшение параметра ведет к большему упрочнению, чем его увеличение. Твердые растворы внедрения образуются внедрением атомов растворенного компонента в поры кристаллической решетки растворителя (рис. 4.4 б). Образование таких растворов, возможно, если атомы растворенного элемента имеют малые размеры. Такими являются элементы, находящиеся в начале периодической системы Менделеева, углерод, водород, азот, бор. Размеры атомов превышают размеры межатомных промежутков в кристаллической решетке металла, это вызывает искажение решетки и в ней возникают напряжения. Концентрация таких растворов не превышает 2-2.5% Твердые растворы вычитания или растворы с дефектной решеткой. образуются на базе химических соединений, при этом возможна не только замена одних атомов в узлах кристаллической решетки другими, но и образование пустых, не занятых атомами, узлов в решетке. К химическому соединению добавляют, один из входящих в формулу элементов, его атомы занимают нормальное положение в решетке соединения, а места атомов другого элемента остаются, незанятыми. ^ Кристаллизация сплавов. Кристаллизация сплавов подчиняется тем же закономерностям, что и кристаллизация чистых металлов. Необходимым условием является стремление системы в состояние с минимумом свободной энергии. Основным отличием является большая роль диффузионных процессов, между жидкостью и кристаллизующейся фазой. Эти процессы необходимы для перераспределения разнородных атомов, равномерно распределенных в жидкой фазе. В сплавах в твердых состояниях, имеют место процессы перекристаллизации, обусловленные аллотропическими превращениями компонентов сплава, распадом твердых растворов, выделением из твердых растворов вторичных фаз, когда растворимость компонентов в твердом состоянии меняется с изменением температуры. Эти превращения называют фазовыми превращениями в твердом состоянии. При перекристаллизации в твердом состоянии образуются центры кристаллизации и происходит их рост. Обычно центры кристаллизации возникают по границам зерен старой фазы, где решетка имеет наиболее дефектное строение, и где имеются примеси, которые могут стать центрами новых кристаллов. У старой и новой фазы, в течение некоторого времени, имеются общие плоскости. Такая связь решеток называется когерентной связью. В случае различия строения старой и новой фаз превращение протекает с образованием промежуточных фаз. Нарушение когерентности и обособления кристаллов наступает, когда они приобретут определенные размеры. Процессы кристаллизации сплавов изучаются по диаграммам состояния. ^ Диаграмма состояния. Диаграмма состояния представляетсобой графическое изображение состояния любого сплава изучаемой системы в зависимости от концентрации и температуры (рис. 4.5).  Рис. 4.5. Диаграмма состояния Диаграммы состояния показывают устойчивые состояния, т.е. состояния, которые при данных условиях обладают минимумом свободной энергии, и поэтому ее также называют диаграммой равновесия, так как она показывает, какие при данных условиях существуют равновесные фазы. Построение диаграмм состояния наиболее часто осуществляется при помощи термического анализа.^ В результате получают серию кривых охлаждения, на которых при температурах фазовых превращений наблюдаются точки перегиба и температурные остановки. Температуры, соответствующие фазовым превращениям, называют критическими точками. Некоторые критические точки имеют названия, например, точки отвечающие началу кристаллизации называют точками ликвидус, а концу кристаллизации – точками солидус. По кривым охлаждения строят диаграмму состава в координатах: по оси абсцисс –концентрация компонентов, по оси ординат – температура. Шкала концентраций показывает содержание компонента В. Основными линиями являются линии ликвидус (1) и солидус (2), а также линии соответствующие фазовым превращениям в твердом состоянии (3, 4). По диаграмме состояния можно определить температуры фазовых превращений, изменение фазового состава, приблизительно, свойства сплава, виды обработки, которые можно применять для сплава. ^ Диаграммы состояния двухкомпонентных сплавов. Диаграмма состояния сплавов с неограниченной растворимостью компонентов в твердом состоянии (сплавы твердые растворы с неограниченной растворимостью) Диаграмма состояния и кривые охлаждения сплавов системы представлены на рис. 5.1. Рис. 4.5. Диаграмма состояния Диаграммы состояния показывают устойчивые состояния, т.е. состояния, которые при данных условиях обладают минимумом свободной энергии, и поэтому ее также называют диаграммой равновесия, так как она показывает, какие при данных условиях существуют равновесные фазы. Построение диаграмм состояния наиболее часто осуществляется при помощи термического анализа.^ В результате получают серию кривых охлаждения, на которых при температурах фазовых превращений наблюдаются точки перегиба и температурные остановки. Температуры, соответствующие фазовым превращениям, называют критическими точками. Некоторые критические точки имеют названия, например, точки отвечающие началу кристаллизации называют точками ликвидус, а концу кристаллизации – точками солидус. По кривым охлаждения строят диаграмму состава в координатах: по оси абсцисс –концентрация компонентов, по оси ординат – температура. Шкала концентраций показывает содержание компонента В. Основными линиями являются линии ликвидус (1) и солидус (2), а также линии соответствующие фазовым превращениям в твердом состоянии (3, 4). По диаграмме состояния можно определить температуры фазовых превращений, изменение фазового состава, приблизительно, свойства сплава, виды обработки, которые можно применять для сплава. ^ Диаграммы состояния двухкомпонентных сплавов. Диаграмма состояния сплавов с неограниченной растворимостью компонентов в твердом состоянии (сплавы твердые растворы с неограниченной растворимостью) Диаграмма состояния и кривые охлаждения сплавов системы представлены на рис. 5.1. 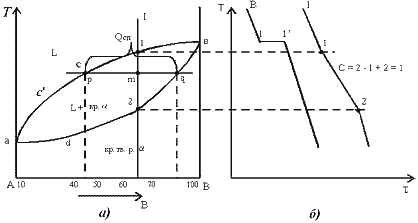 Рис.5.1 Диаграмма состояния сплавов с неограниченной растворимостью компонентов в твердом состоянии (а); кривые охлаждения типичных сплавов (б) Сначала получают термические кривые. Полученные точки переносят на диаграмму, соединив точки начала кристаллизации сплавов и точки конца кристаллизации, получают диаграмму состояния. Проведем анализ полученной диаграммы. 1. Количество компонентов: К = 2 (компоненты А и В). 2. Число фаз: f = 2 (жидкая фаза L, кристаллы твердого раствора Рис.5.1 Диаграмма состояния сплавов с неограниченной растворимостью компонентов в твердом состоянии (а); кривые охлаждения типичных сплавов (б) Сначала получают термические кривые. Полученные точки переносят на диаграмму, соединив точки начала кристаллизации сплавов и точки конца кристаллизации, получают диаграмму состояния. Проведем анализ полученной диаграммы. 1. Количество компонентов: К = 2 (компоненты А и В). 2. Число фаз: f = 2 (жидкая фаза L, кристаллы твердого раствора 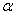 ) 3. Основные линии диаграммы: ) 3. Основные линии диаграммы:
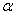 . На кривой охлаждения отмечается перегиб (критическая точка), связанный с уменьшением скорости охлаждения вследствие выделения скрытой теплоты кристаллизации. На участке 1–2 идет процесс кристаллизации, протекающий при понижающейся температуре, так как согласно правилу фаз в двухкомпонентной системе при наличии двух фаз (жидкой и кристаллов твердого раствора . На кривой охлаждения отмечается перегиб (критическая точка), связанный с уменьшением скорости охлаждения вследствие выделения скрытой теплоты кристаллизации. На участке 1–2 идет процесс кристаллизации, протекающий при понижающейся температуре, так как согласно правилу фаз в двухкомпонентной системе при наличии двух фаз (жидкой и кристаллов твердого раствора 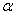 ) число степеней свободы будет равно единице ) число степеней свободы будет равно единице 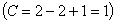 . При достижении температуры соответствующей точке 2, сплав затвердевает, при дальнейшем понижении температуры охлаждается сплав в твердом состоянии, состоящий из однородных кристаллов твердого раствора . При достижении температуры соответствующей точке 2, сплав затвердевает, при дальнейшем понижении температуры охлаждается сплав в твердом состоянии, состоящий из однородных кристаллов твердого раствора 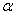 . Схема микроструктуры сплава представлена на рис. 5.2. . Схема микроструктуры сплава представлена на рис. 5.2.  Рис. 5.2. Схема микроструктуры сплава – однородного твердого раствора 5. Количественный структурно-фазовый анализ сплава. Пользуясь диаграммой состояния можно для любого сплава при любой температуре определить не только число фаз, но и их состав и количественное соотношение. Для этого используется правило отрезков. Для проведения количественного структурно-фазового анализа через заданную точку проводят горизонталь (коноду) до пересечения с ближайшими линиями диаграммы (ликвидус, солидус или оси компонентов). а). Определение состава фаз в точке m: Для его определения через точку m проводят горизонталь до пересечения с ближайшими линиями диаграммы: ликвидус и солидус. Состав жидкой фазы определяется проекцией точки пересечения горизонтали с линией ликвидус p на ось концентрации. Состав твердой фазы определяется проекцией точки пересечения горизонтали с линией солидус q (или осью компонента) на ось концентрации. Состав жидкой фазы изменяется по линии ликвидуса, а состав твердой фазы – по линии солидуса. С понижением температуры состав фаз изменяется в сторону уменьшения содержания компонента В. б). Определение количественного соотношения жидкой и твердой фазы при заданной температуре (в точке m): Количественная масса фаз обратно пропорциональна отрезкам проведенной коноды.Рассмотрим проведенную через точку m коноду и ее отрезки. Количество всего сплава (Qсп) определяется отрезком pq.О трезок, прилегающий к линии ликвидус pm, определяет количество твердой фазы. Рис. 5.2. Схема микроструктуры сплава – однородного твердого раствора 5. Количественный структурно-фазовый анализ сплава. Пользуясь диаграммой состояния можно для любого сплава при любой температуре определить не только число фаз, но и их состав и количественное соотношение. Для этого используется правило отрезков. Для проведения количественного структурно-фазового анализа через заданную точку проводят горизонталь (коноду) до пересечения с ближайшими линиями диаграммы (ликвидус, солидус или оси компонентов). а). Определение состава фаз в точке m: Для его определения через точку m проводят горизонталь до пересечения с ближайшими линиями диаграммы: ликвидус и солидус. Состав жидкой фазы определяется проекцией точки пересечения горизонтали с линией ликвидус p на ось концентрации. Состав твердой фазы определяется проекцией точки пересечения горизонтали с линией солидус q (или осью компонента) на ось концентрации. Состав жидкой фазы изменяется по линии ликвидуса, а состав твердой фазы – по линии солидуса. С понижением температуры состав фаз изменяется в сторону уменьшения содержания компонента В. б). Определение количественного соотношения жидкой и твердой фазы при заданной температуре (в точке m): Количественная масса фаз обратно пропорциональна отрезкам проведенной коноды.Рассмотрим проведенную через точку m коноду и ее отрезки. Количество всего сплава (Qсп) определяется отрезком pq.О трезок, прилегающий к линии ликвидус pm, определяет количество твердой фазы. 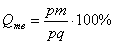 Отрезок, прилегающий к линии солидус (или к оси компонента) mq, определяет количество жидкой фазы. Отрезок, прилегающий к линии солидус (или к оси компонента) mq, определяет количество жидкой фазы. 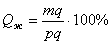 ^ Диаграмма состояния сплавов с отсутствием растворимости компонентов в компонентов в твердом состоянии (механические смеси) Диаграмма состояния и кривые охлаждения типичных сплавов системы представлены на рис. 5.3. ^ Диаграмма состояния сплавов с отсутствием растворимости компонентов в компонентов в твердом состоянии (механические смеси) Диаграмма состояния и кривые охлаждения типичных сплавов системы представлены на рис. 5.3. 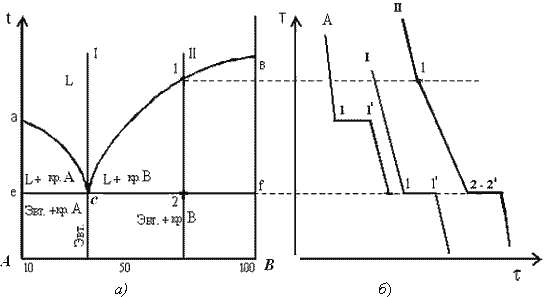 Рис. 5.3. Диаграмма состояния сплавов с отсутствием растворимости компонентов в твердом состоянии (а) и кривые охлаждения сплавов (б) Проведем анализ диаграммы состояния. 1. Количество компонентов: К = 2 (компоненты А и В); 2. Число фаз: f = 3 (кристаллы компонента А, кристаллы компонента В, жидкая фаза). 3. Основные линии диаграммы: линия· ликвидус acb, состоит из двух ветвей, сходящихся в одной точке; линия· солидус ecf, параллельна оси концентраций стремится к осям компонентов, но не достигает их; Рис. 5.3. Диаграмма состояния сплавов с отсутствием растворимости компонентов в твердом состоянии (а) и кривые охлаждения сплавов (б) Проведем анализ диаграммы состояния. 1. Количество компонентов: К = 2 (компоненты А и В); 2. Число фаз: f = 3 (кристаллы компонента А, кристаллы компонента В, жидкая фаза). 3. Основные линии диаграммы: линия· ликвидус acb, состоит из двух ветвей, сходящихся в одной точке; линия· солидус ecf, параллельна оси концентраций стремится к осям компонентов, но не достигает их;
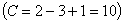 . В точке 1/ процесс кристаллизации завершается. Ниже точки 1/ охлаждается сплав, состоящий из дисперсных разнородных кристаллов компонентов А и В. в) Другие сплавы системы аналогичны сплаву II, кривую охлаждения сплава см на рис 5.3.б. ^ Процесс кристаллизации сплава II: до точки 1 охлаждается сплав в жидком состоянии. При температуре, соответствующей точке 1, начинают образовываться центры кристаллизации избыточного компонента В. На кривой охлаждения отмечается перегиб (критическая точка), связанный с уменьшением скорости охлаждения вследствие выделения скрытой теплоты кристаллизации. На участке 1–2 идет процесс кристаллизации, протекающий при понижающейся температуре, так как согласно правилу фаз в двухкомпонентной системе при наличии двух фаз (жидкой и кристаллов компонента В) число степеней свободы будет равно единице . В точке 1/ процесс кристаллизации завершается. Ниже точки 1/ охлаждается сплав, состоящий из дисперсных разнородных кристаллов компонентов А и В. в) Другие сплавы системы аналогичны сплаву II, кривую охлаждения сплава см на рис 5.3.б. ^ Процесс кристаллизации сплава II: до точки 1 охлаждается сплав в жидком состоянии. При температуре, соответствующей точке 1, начинают образовываться центры кристаллизации избыточного компонента В. На кривой охлаждения отмечается перегиб (критическая точка), связанный с уменьшением скорости охлаждения вследствие выделения скрытой теплоты кристаллизации. На участке 1–2 идет процесс кристаллизации, протекающий при понижающейся температуре, так как согласно правилу фаз в двухкомпонентной системе при наличии двух фаз (жидкой и кристаллов компонента В) число степеней свободы будет равно единице 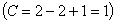 . При охлаждении состав жидкой фазы изменяется по линии ликвидус до эвтектического. На участке 2–2’ кристаллизуется эвтектика (см. кристаллизацию эвтектического сплава). Ниже точки 2’ охлаждается сплав, состоящий из кристаллов первоначально закристаллизовавшегося избыточного компонента В и эвтектики. Схема микроструктуры сплава представлена на рис. 5.4. . При охлаждении состав жидкой фазы изменяется по линии ликвидус до эвтектического. На участке 2–2’ кристаллизуется эвтектика (см. кристаллизацию эвтектического сплава). Ниже точки 2’ охлаждается сплав, состоящий из кристаллов первоначально закристаллизовавшегося избыточного компонента В и эвтектики. Схема микроструктуры сплава представлена на рис. 5.4.  Рис. 5.4. Схема микроструктур сплавов: а – доэвтектического, б – эвтектического, в – заэвтектического 5. При проведении количественного структурно-фазового анализа, конода, проведенная через заданную точку, пересекает линию ликвидус и оси компонентов, поэтому состав твердой фазы или 100 % компонента А, или 100 % компонента В. Рис. 5.4. Схема микроструктур сплавов: а – доэвтектического, б – эвтектического, в – заэвтектического 5. При проведении количественного структурно-фазового анализа, конода, проведенная через заданную точку, пересекает линию ликвидус и оси компонентов, поэтому состав твердой фазы или 100 % компонента А, или 100 % компонента В. |
Диаграмма состояния сплавов с ограниченной растворимостью компонентов в твердом состоянии Диаграмма состояния и кривые охлаждения типичных сплавов системы представлены на рис.5.5. 1. Количество компонентов: К = 2 (компоненты А и В); 2. Число фаз: f = 3 (жидкая фаза и кристаллы твердых растворов 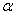 (раствор компонента В в компоненте А) и (раствор компонента В в компоненте А) и 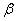 (раствор компонента А в компоненте В)); 3. Основные линии диаграммы: линия ликвидус acb, состоит из· двух ветвей, сходящихся в одной точке; линия солидус аdcfb, состоит из· трех участков; dm – линия предельной концентрации компонента В в· компоненте А; fn – линия предельной концентрации компонента А в· компоненте В. 4. Типовые сплавы системы. При концентрации компонентов, не превышающей предельных значений (на участках Аm и nВ), сплавы кристаллизуются аналогично сплавам твердым растворам с неограниченной растворимостью, см кривую охлаждения сплава I на рис. 5.5 б. При концентрации компонентов, превышающей предельные значения (на участке dcf), сплавы кристаллизуются аналогично сплавам механическим смесям, см. кривую охлаждения сплава II на рис. 5.5 б. (раствор компонента А в компоненте В)); 3. Основные линии диаграммы: линия ликвидус acb, состоит из· двух ветвей, сходящихся в одной точке; линия солидус аdcfb, состоит из· трех участков; dm – линия предельной концентрации компонента В в· компоненте А; fn – линия предельной концентрации компонента А в· компоненте В. 4. Типовые сплавы системы. При концентрации компонентов, не превышающей предельных значений (на участках Аm и nВ), сплавы кристаллизуются аналогично сплавам твердым растворам с неограниченной растворимостью, см кривую охлаждения сплава I на рис. 5.5 б. При концентрации компонентов, превышающей предельные значения (на участке dcf), сплавы кристаллизуются аналогично сплавам механическим смесям, см. кривую охлаждения сплава II на рис. 5.5 б. 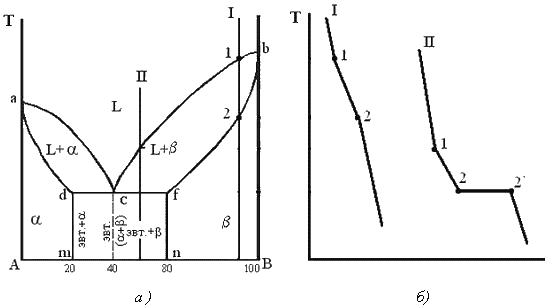 Рис. 5.5 Диаграмма состояния сплавов с ограниченной растворимостью компонентов в твердом состоянии (а) и кривые охлаждения типичных сплавов (б) Сплав с концентрацией компонентов, соответствующей точке с, является эвтектическим сплавом. Сплав состоит из мелкодисперсных кристаллов твердых растворов Рис. 5.5 Диаграмма состояния сплавов с ограниченной растворимостью компонентов в твердом состоянии (а) и кривые охлаждения типичных сплавов (б) Сплав с концентрацией компонентов, соответствующей точке с, является эвтектическим сплавом. Сплав состоит из мелкодисперсных кристаллов твердых растворов 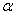 и и 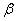 , эвт. (кр. тв. р-ра , эвт. (кр. тв. р-ра 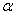 + кр. тв. р-ра + кр. тв. р-ра 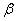 ) Кристаллы компонентов в чистом виде ни в одном из сплавов не присутствуют. Диаграмма состояния сплавов, компоненты которых образуют химические соединения. Диаграмма состояния сплавов представлена на рис. 5.6. ) Кристаллы компонентов в чистом виде ни в одном из сплавов не присутствуют. Диаграмма состояния сплавов, компоненты которых образуют химические соединения. Диаграмма состояния сплавов представлена на рис. 5.6. 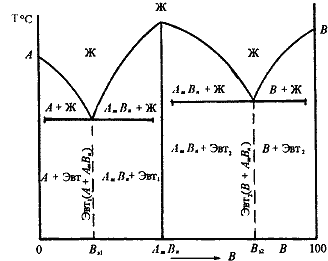 Рис. 5.6. Диаграмма состояния сплавов, компоненты которых образуют химические соединения Диаграмма состояния сложная, состоит из нескольких простых диаграмм. Число компонентов и количество диаграмм зависит от того, сколько химических соединений образуют основные компоненты системы. Число фаз и вид простых диаграмм определяются характером взаимодействия между компонентами. Эвт1 (кр. А + кр. AmBn); Эвт2 (кр. B + кр. AmBn). ^ Диаграмма состояния сплавов, испытывающих фазовые превращения в твердом состоянии (переменная растворимость) Диаграмма состояния представлена на рис. 5.7. По внешнему виду диаграмма похожа на диаграмму состояния сплавов с ограниченной растворимостью компонентов в твердом состоянии. Отличие в том, что линии предельной растворимости компонентов не перпендикулярны оси концентрации. Появляются области, в которых из однородных твердых растворов при понижении температуры выделяются вторичные фазы. На диаграмме: df – линия переменной предельной растворимости компонента В· в компоненте А; ek – линия переменной предельной растворимости· компонента А в компоненте В. Кривая охлаждения сплава I представлена на рис. 5.7 б. Рис. 5.6. Диаграмма состояния сплавов, компоненты которых образуют химические соединения Диаграмма состояния сложная, состоит из нескольких простых диаграмм. Число компонентов и количество диаграмм зависит от того, сколько химических соединений образуют основные компоненты системы. Число фаз и вид простых диаграмм определяются характером взаимодействия между компонентами. Эвт1 (кр. А + кр. AmBn); Эвт2 (кр. B + кр. AmBn). ^ Диаграмма состояния сплавов, испытывающих фазовые превращения в твердом состоянии (переменная растворимость) Диаграмма состояния представлена на рис. 5.7. По внешнему виду диаграмма похожа на диаграмму состояния сплавов с ограниченной растворимостью компонентов в твердом состоянии. Отличие в том, что линии предельной растворимости компонентов не перпендикулярны оси концентрации. Появляются области, в которых из однородных твердых растворов при понижении температуры выделяются вторичные фазы. На диаграмме: df – линия переменной предельной растворимости компонента В· в компоненте А; ek – линия переменной предельной растворимости· компонента А в компоненте В. Кривая охлаждения сплава I представлена на рис. 5.7 б. 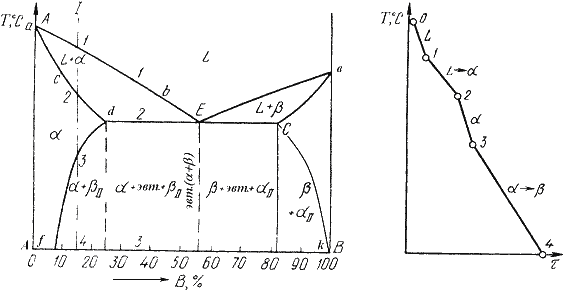 Рис. 5.7. Диаграмма состояния сплавов, испытывающих фазовые превращения в твердом состоянии (а) и кривая охлаждения сплава (б) ^ Процесс кристаллизации сплава I: до точки 1 охлаждается сплав в жидком состоянии. При температуре, соответствующей точке 1, начинают образовываться центры кристаллизации твердого раствора Рис. 5.7. Диаграмма состояния сплавов, испытывающих фазовые превращения в твердом состоянии (а) и кривая охлаждения сплава (б) ^ Процесс кристаллизации сплава I: до точки 1 охлаждается сплав в жидком состоянии. При температуре, соответствующей точке 1, начинают образовываться центры кристаллизации твердого раствора  . На участке 1–2 идет процесс кристаллизации, протекающий при понижающейся температуре. При достижении температуры соответствующей точке 2, сплав затвердевает, при дальнейшем понижении температуры охлаждается сплав в твердом состоянии, состоящий из однородных кристаллов твердого раствора . На участке 1–2 идет процесс кристаллизации, протекающий при понижающейся температуре. При достижении температуры соответствующей точке 2, сплав затвердевает, при дальнейшем понижении температуры охлаждается сплав в твердом состоянии, состоящий из однородных кристаллов твердого раствора  . При достижении температуры, соответствующей точке 3, твердый раствор . При достижении температуры, соответствующей точке 3, твердый раствор 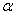 оказывается насыщенным компонентом В, при более низких температурах растворимость второго компонента уменьшается, поэтому из оказывается насыщенным компонентом В, при более низких температурах растворимость второго компонента уменьшается, поэтому из 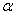 -раствора начинает выделяться избыточный компонент в виде кристаллов -раствора начинает выделяться избыточный компонент в виде кристаллов 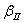 . За точкой 3 сплав состоит из двух фаз: кристаллов твердого раствора . За точкой 3 сплав состоит из двух фаз: кристаллов твердого раствора 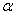 и вторичных кристаллов твердого раствора и вторичных кристаллов твердого раствора 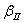 . ^ Связь между свойствами сплавов и типом диаграммы состояния Так как вид диаграммы, также как и свойства сплава, зависит от того, какие соединения или какие фазы образовали компоненты сплава, то между ними должна существовать определенная связь. Эта зависимость установлена Курнаковым, (см. рис. 5.8.). . ^ Связь между свойствами сплавов и типом диаграммы состояния Так как вид диаграммы, также как и свойства сплава, зависит от того, какие соединения или какие фазы образовали компоненты сплава, то между ними должна существовать определенная связь. Эта зависимость установлена Курнаковым, (см. рис. 5.8.). 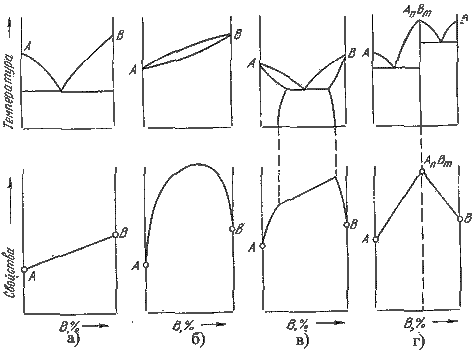 Рис. 5.8. Связь между свойствами сплавов и типом диаграммы состояния Рис. 5.8. Связь между свойствами сплавов и типом диаграммы состояния
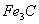 . Каждое устойчивое химическое соединение можно рассматривать как компонент, а диаграмму – по частям. Так как на практике применяют металлические сплавы с содержанием углерода до . Каждое устойчивое химическое соединение можно рассматривать как компонент, а диаграмму – по частям. Так как на практике применяют металлические сплавы с содержанием углерода до 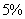 , то рассматриваем часть диаграммы состояния от железа до химического соединения цементита, содержащего , то рассматриваем часть диаграммы состояния от железа до химического соединения цементита, содержащего 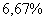 углерода. Диаграмма состояния железо – цементит представлена на рис. 9.1. углерода. Диаграмма состояния железо – цементит представлена на рис. 9.1. 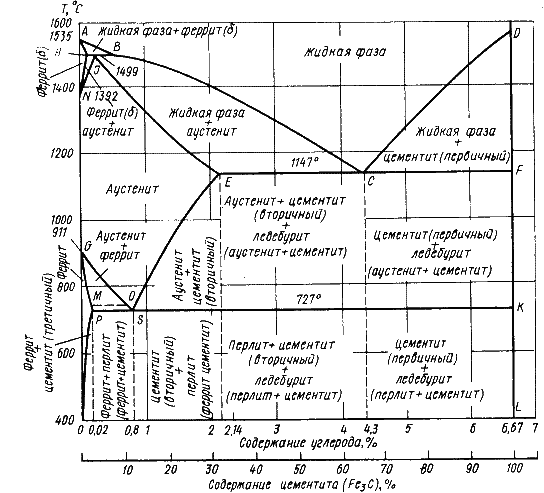 Рис. 9.1. Диаграмма состояния железо - цементит Компоненты и фазы железоуглеродистых сплавов Компонентами железоуглеродистых сплавов являются железо, углерод и цементит. 1. Железо – переходный металл серебристо-светлого цвета. Имеет высокую температуру плавления – 1539o С Рис. 9.1. Диаграмма состояния железо - цементит Компоненты и фазы железоуглеродистых сплавов Компонентами железоуглеродистых сплавов являются железо, углерод и цементит. 1. Железо – переходный металл серебристо-светлого цвета. Имеет высокую температуру плавления – 1539o С 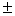 5o ^ С. В твердом состоянии железо может находиться в двух модификациях. Полиморфные превращения происходят при температурах 911o С и 1392o С. При температуре ниже 911o С существует 5o ^ С. В твердом состоянии железо может находиться в двух модификациях. Полиморфные превращения происходят при температурах 911o С и 1392o С. При температуре ниже 911o С существует  с объемно-центрированной кубической решеткой. В интервале температур 911…1392o С устойчивым является с объемно-центрированной кубической решеткой. В интервале температур 911…1392o С устойчивым является 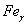 с гранецентрированной кубической решеткой. Выше 1392o С железо имеет объемно-центрированную кубическую решетку и называется с гранецентрированной кубической решеткой. Выше 1392o С железо имеет объемно-центрированную кубическую решетку и называется 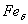 или высокотемпературное или высокотемпературное  . Высокотемпературная модификация . Высокотемпературная модификация  не представляет собой новой аллотропической формы. Критическую температуру 911oС превращения не представляет собой новой аллотропической формы. Критическую температуру 911oС превращения 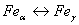 обозначают точкой обозначают точкой 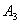 , а температуру 1392o С превращения , а температуру 1392o С превращения 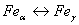 - точкой А4. При температуре ниже 768o ^ С железо ферромагнитно, а выше – парамагнитно. Точка Кюри железа 768o С обозначается А2. Железо технической чистоты обладает невысокой твердостью (80 НВ) и прочностью (предел прочности – - точкой А4. При температуре ниже 768o ^ С железо ферромагнитно, а выше – парамагнитно. Точка Кюри железа 768o С обозначается А2. Железо технической чистоты обладает невысокой твердостью (80 НВ) и прочностью (предел прочности – 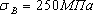 , предел текучести – , предел текучести – 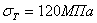 ) и высокими характеристиками пластичности (относительное удлинение – ) и высокими характеристиками пластичности (относительное удлинение – 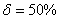 , а относительное сужение – , а относительное сужение – 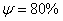 ). Свойства могут изменяться в некоторых пределах в зависимости от величины зерна. Железо характеризуется высоким модулем упругости, наличие которого проявляется и в сплавах на его основе, обеспечивая высокую жесткость деталей из этих сплавов. Железо со многими элементами образует растворы: с металлами – растворы замещения, с углеродом, азотом и водородом – растворы внедрения. 2. Углерод относится к неметаллам. Обладает полиморфным превращением, в зависимости от условий образования существует в форме графита с гексагональной кристаллической решеткой (температура плавления – 3500 0 С, плотность – 2,5 г/см3) или в форме алмаза со сложной кубической решеткой с координационным числом равным четырем (температура плавления – 5000 0 С). В сплавах железа с углеродом углерод находится в состоянии твердого раствора с железом и в виде химического соединения – цементита (Fe3C), а также в свободном состоянии в виде графита (в серых чугунах). 3. Цементит (Fe3C) – химическое соединение железа с углеродом (карбид железа), содержит 6,67 % углерода. Аллотропических превращений не испытывает. Кристаллическая решетка цементита состоит из ряда октаэдров, оси которых наклонены друг к другу. Температура плавления цементита точно не установлена (1250, 1550o ^ С). При низких температурах цементит слабо ферромагнитен, магнитные свойства теряет при температуре около 217o С. Цементит имеет высокую твердость (более 800 НВ, легко царапает стекло), но чрезвычайно низкую, практически нулевую, пластичность. Такие свойства являются следствием сложного строения кристаллической решетки. Цементит способен образовывать твердые растворы замещения. Атомы углерода могут замещаться атомами неметаллов: азотом, кислородом; атомы железа – металлами: марганцем, хромом, вольфрамом и др. Такой твердый раствор на базе решетки цементита называется легированным цементитом. Цементит – соединение неустойчивое и при определенных условиях распадается с образованием свободного углерода в виде графита. Этот процесс имеет важное практическое значение при структурообразовании чугунов. В системе железо – углерод существуют следующие фазы: жидкая фаза, феррит, аустенит, цементит. 1. Жидкая фаза. В жидком состоянии железо хорошо растворяет углерод в любых пропорциях с образованием однородной жидкой фазы. 2. Феррит (Ф) ). Свойства могут изменяться в некоторых пределах в зависимости от величины зерна. Железо характеризуется высоким модулем упругости, наличие которого проявляется и в сплавах на его основе, обеспечивая высокую жесткость деталей из этих сплавов. Железо со многими элементами образует растворы: с металлами – растворы замещения, с углеродом, азотом и водородом – растворы внедрения. 2. Углерод относится к неметаллам. Обладает полиморфным превращением, в зависимости от условий образования существует в форме графита с гексагональной кристаллической решеткой (температура плавления – 3500 0 С, плотность – 2,5 г/см3) или в форме алмаза со сложной кубической решеткой с координационным числом равным четырем (температура плавления – 5000 0 С). В сплавах железа с углеродом углерод находится в состоянии твердого раствора с железом и в виде химического соединения – цементита (Fe3C), а также в свободном состоянии в виде графита (в серых чугунах). 3. Цементит (Fe3C) – химическое соединение железа с углеродом (карбид железа), содержит 6,67 % углерода. Аллотропических превращений не испытывает. Кристаллическая решетка цементита состоит из ряда октаэдров, оси которых наклонены друг к другу. Температура плавления цементита точно не установлена (1250, 1550o ^ С). При низких температурах цементит слабо ферромагнитен, магнитные свойства теряет при температуре около 217o С. Цементит имеет высокую твердость (более 800 НВ, легко царапает стекло), но чрезвычайно низкую, практически нулевую, пластичность. Такие свойства являются следствием сложного строения кристаллической решетки. Цементит способен образовывать твердые растворы замещения. Атомы углерода могут замещаться атомами неметаллов: азотом, кислородом; атомы железа – металлами: марганцем, хромом, вольфрамом и др. Такой твердый раствор на базе решетки цементита называется легированным цементитом. Цементит – соединение неустойчивое и при определенных условиях распадается с образованием свободного углерода в виде графита. Этот процесс имеет важное практическое значение при структурообразовании чугунов. В системе железо – углерод существуют следующие фазы: жидкая фаза, феррит, аустенит, цементит. 1. Жидкая фаза. В жидком состоянии железо хорошо растворяет углерод в любых пропорциях с образованием однородной жидкой фазы. 2. Феррит (Ф)  (C) – твердый раствор внедрения углерода в (C) – твердый раствор внедрения углерода в 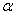 -железо. Феррит имеет переменную предельную растворимость углерода: минимальную – ^ 0,006 % при комнатной температуре (точка Q), максимальную – 0,02 % при температуре 727o С (точка P). Углерод располагается в дефектах решетки. При температуре выше 1392o С существует высокотемпературный феррит ( -железо. Феррит имеет переменную предельную растворимость углерода: минимальную – ^ 0,006 % при комнатной температуре (точка Q), максимальную – 0,02 % при температуре 727o С (точка P). Углерод располагается в дефектах решетки. При температуре выше 1392o С существует высокотемпературный феррит (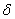 ) ( ) (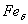 (C), с предельной растворимостью углерода 0,1 % при температуре 1499o С (точка J) Свойства феррита близки к свойствам железа. Он мягок (твердость – 130 НВ, предел прочности – (C), с предельной растворимостью углерода 0,1 % при температуре 1499o С (точка J) Свойства феррита близки к свойствам железа. Он мягок (твердость – 130 НВ, предел прочности – 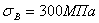 ) и пластичен (относительное удлинение – ) и пластичен (относительное удлинение – 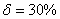 ), магнитен до 768o С. 3. Аустенит (А) ), магнитен до 768o С. 3. Аустенит (А) 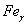 (С) – твердый раствор внедрения углерода в (С) – твердый раствор внедрения углерода в 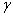 -железо. Углерод занимает место в центре гранецентрированной кубической ячейки. Аустенит имеет переменную предельную растворимость углерода: минимальную – ^ 0,8 % при температуре 727o С (точка S), максимальную – 2,14 % при температуре 1147o С (точка Е). Аустенит имеет твердость 200…250 НВ, пластичен (относительное удлинение – -железо. Углерод занимает место в центре гранецентрированной кубической ячейки. Аустенит имеет переменную предельную растворимость углерода: минимальную – ^ 0,8 % при температуре 727o С (точка S), максимальную – 2,14 % при температуре 1147o С (точка Е). Аустенит имеет твердость 200…250 НВ, пластичен (относительное удлинение – 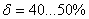 ), парамагнитен. При растворении в аустените других элементов могут изменяться свойства и температурные границы существования. 4. Цементит – характеристика дана выше. В железоуглеродистых сплавах присутствуют фазы: цементит первичный (ЦI), цементит вторичный (ЦII), цементит третичный (ЦIII). Химические и физические свойства этих фаз одинаковы. Влияние на механические свойства сплавов оказывает различие в размерах, количестве и расположении этих выделений. Цементит первичный выделяется из жидкой фазы в виде крупных пластинчатых кристаллов. Цементит вторичный выделяется из аустенита и располагается в виде сетки вокруг зерен аустенита (при охлаждении – вокруг зерен перлита). Цементит третичный выделяется из феррита и в виде мелких включений располагается у границ ферритных зерен. ^ Процессы при структурообразовании железоуглеродистых сплавов Линия АВСD – ликвидус системы. На участке АВ начинается кристаллизация феррита ( ), парамагнитен. При растворении в аустените других элементов могут изменяться свойства и температурные границы существования. 4. Цементит – характеристика дана выше. В железоуглеродистых сплавах присутствуют фазы: цементит первичный (ЦI), цементит вторичный (ЦII), цементит третичный (ЦIII). Химические и физические свойства этих фаз одинаковы. Влияние на механические свойства сплавов оказывает различие в размерах, количестве и расположении этих выделений. Цементит первичный выделяется из жидкой фазы в виде крупных пластинчатых кристаллов. Цементит вторичный выделяется из аустенита и располагается в виде сетки вокруг зерен аустенита (при охлаждении – вокруг зерен перлита). Цементит третичный выделяется из феррита и в виде мелких включений располагается у границ ферритных зерен. ^ Процессы при структурообразовании железоуглеродистых сплавов Линия АВСD – ликвидус системы. На участке АВ начинается кристаллизация феррита (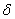 ), на участке ^ ВС начинается кристаллизация аустенита, на участке СD – кристаллизация цементита первичного. Линия AHJECF – линия солидус. На участке АН заканчивается кристаллизация феррита ( ), на участке ^ ВС начинается кристаллизация аустенита, на участке СD – кристаллизация цементита первичного. Линия AHJECF – линия солидус. На участке АН заканчивается кристаллизация феррита (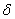 ). На линии HJB при постоянной температуре 14990С идет перетектическое превращение, заключающееся в том, что жидкая фаза реагирует с ранее образовавшимися кристаллами феррита ( ). На линии HJB при постоянной температуре 14990С идет перетектическое превращение, заключающееся в том, что жидкая фаза реагирует с ранее образовавшимися кристаллами феррита (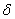 ), в результате чего образуется аустенит: ), в результате чего образуется аустенит: 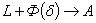 На участке JЕ заканчивается кристаллизация аустенита. На участке ECF при постоянной температуре 1147o С идет эвтектическое превращение, заключающееся в том, что жидкость, содержащая 4,3 % углерода превращается в эвтектическую смесь аустенита и цементита первичного: На участке JЕ заканчивается кристаллизация аустенита. На участке ECF при постоянной температуре 1147o С идет эвтектическое превращение, заключающееся в том, что жидкость, содержащая 4,3 % углерода превращается в эвтектическую смесь аустенита и цементита первичного: 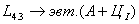 Эвтектика системы железо – цементит называется ледебуритом (Л), по имени немецкого ученого Ледебура, содержит 4,3 % углерода. При температуре ниже 727o С в состав ледебурита входят цементит первичный и перлит, его называют ледебурит превращенный (ЛП). По линии HN начинается превращение феррита ( Эвтектика системы железо – цементит называется ледебуритом (Л), по имени немецкого ученого Ледебура, содержит 4,3 % углерода. При температуре ниже 727o С в состав ледебурита входят цементит первичный и перлит, его называют ледебурит превращенный (ЛП). По линии HN начинается превращение феррита (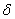 ) в аустенит, обусловленное полиморфным превращением железа. По линии NJ превращение феррита ( ) в аустенит, обусловленное полиморфным превращением железа. По линии NJ превращение феррита (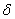 ) в аустенит заканчивается. По линии GS превращение аустенита в феррит, обусловленное полиморфным превращением железа. По линии PG превращение аустенита в феррит заканчивается. По линии ES начинается выделение цементита вторичного из аустенита, обусловленное снижением растворимости углерода в аустените при понижении температуры. По линии МО при постоянной температуре 768o С имеют место магнитные превращения. По линии PSK при постоянной температуре 727o С идет эвтектоидное превращение, заключающееся в том, что аустенит, содержащий 0,8 % углерода, превращается в эвтектоидную смесь феррита и цементита вторичного: ) в аустенит заканчивается. По линии GS превращение аустенита в феррит, обусловленное полиморфным превращением железа. По линии PG превращение аустенита в феррит заканчивается. По линии ES начинается выделение цементита вторичного из аустенита, обусловленное снижением растворимости углерода в аустените при понижении температуры. По линии МО при постоянной температуре 768o С имеют место магнитные превращения. По линии PSK при постоянной температуре 727o С идет эвтектоидное превращение, заключающееся в том, что аустенит, содержащий 0,8 % углерода, превращается в эвтектоидную смесь феррита и цементита вторичного: 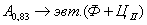 По механизму данное превращение похоже на эвтектическое, но протекает в твердом состоянии. Эвтектоид системы железо – цементит называется перлитом (П), содержит 0,8 % углерода. Название получил за то, что на полированном и протравленном шлифе наблюдается перламутровый блеск. Перлит может существовать в зернистой и пластинчатой форме, в зависимости от условий образования. По линии PQ начинается выделение цементита третичного из феррита, обусловленное снижением растворимости углерода в феррите при понижении температуры. Температуры, при которых происходят фазовые и структурные превращения в сплавах системы железо – цементит, т.е. критические точки, имеют условные обозначения. Обозначаются буквой А (от французского arret – остановка): А1 – линия PSK (7270С) – превращение П По механизму данное превращение похоже на эвтектическое, но протекает в твердом состоянии. Эвтектоид системы железо – цементит называется перлитом (П), содержит 0,8 % углерода. Название получил за то, что на полированном и протравленном шлифе наблюдается перламутровый блеск. Перлит может существовать в зернистой и пластинчатой форме, в зависимости от условий образования. По линии PQ начинается выделение цементита третичного из феррита, обусловленное снижением растворимости углерода в феррите при понижении температуры. Температуры, при которых происходят фазовые и структурные превращения в сплавах системы железо – цементит, т.е. критические точки, имеют условные обозначения. Обозначаются буквой А (от французского arret – остановка): А1 – линия PSK (7270С) – превращение П 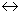 А; A2 – линия MO (7680С, т. Кюри) – магнитные превращения; A3 – линия GOS (переменная температура, зависящая от содержания углерода в сплаве) – превращение Ф А; A2 – линия MO (7680С, т. Кюри) – магнитные превращения; A3 – линия GOS (переменная температура, зависящая от содержания углерода в сплаве) – превращение Ф 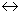 А; A4 – линия NJ (переменная температура, зависящая от содержания углерода в сплаве) – превращение А; A4 – линия NJ (переменная температура, зависящая от содержания углерода в сплаве) – превращение 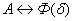 ; Acm – линия SE (переменная температура, зависящая от содержания углерода в сплаве) – начало выделения цементита вторичного (иногда обозначается A3). Так как при нагреве и охлаждении превращения совершаются при различных температурах, чтобы отличить эти процессы вводятся дополнительные обозначения. При нагреве добавляют букву с, т.е ; Acm – линия SE (переменная температура, зависящая от содержания углерода в сплаве) – начало выделения цементита вторичного (иногда обозначается A3). Так как при нагреве и охлаждении превращения совершаются при различных температурах, чтобы отличить эти процессы вводятся дополнительные обозначения. При нагреве добавляют букву с, т.е 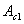 , при охлаждении – букву r, т.е. , при охлаждении – букву r, т.е. 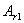 . . |
Структуры железоуглеродистых сплавов Все сплавы системы железо – цементит по структурному признаку делят на две большие группы: стали и чугуны. Особую группу составляют сплавы с содержанием углерода менее 0,02% (точка Р), их называют техническое железо. Микроструктуры сплавов представлены на рис.9.2. Структура таких сплавов после окончания кристаллизации состоит или из зерен феррита (рис.9.2 а), при содержании углерода менее 0,006 %, или из зерен феррита и кристаллов цементита третичного, расположенных по границам зерен феррита (рис.9.2.б), если содержание углерода от 0,006 до 0,02 %. 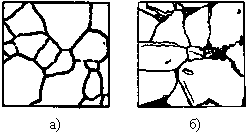 Рис.9.2. Микроструктуры технического железа: а – содержание углерода менее 0,006%; б – содержание углерода 0,006…0,02 % Углеродистыми сталями называют сплавы железа с углеродом, содержащие 0,02…2,14 % углерода, заканчивающие кристаллизацию образованием аустенита. Они обладают высокой пластичностью, особенно в аустенитном состоянии. Структура сталей формируется в результате перекристаллизации аустенита. Микроструктуры сталей представлены на рис. 9.3. Рис.9.2. Микроструктуры технического железа: а – содержание углерода менее 0,006%; б – содержание углерода 0,006…0,02 % Углеродистыми сталями называют сплавы железа с углеродом, содержащие 0,02…2,14 % углерода, заканчивающие кристаллизацию образованием аустенита. Они обладают высокой пластичностью, особенно в аустенитном состоянии. Структура сталей формируется в результате перекристаллизации аустенита. Микроструктуры сталей представлены на рис. 9.3.  Рис. 9.3. Микроструктуры сталей: а – доэвтектоидная сталь Рис. 9.3. Микроструктуры сталей: а – доэвтектоидная сталь 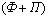 ; б – эвтектоидная сталь (пластинчатый перлит); в – эвтектоидная сталь (зернистый перлит); г – заэвтектоидная сталь ; б – эвтектоидная сталь (пластинчатый перлит); в – эвтектоидная сталь (зернистый перлит); г – заэвтектоидная сталь 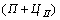 . По содержанию углерода и по структуре стали подразделяются на доэвтектоидные . По содержанию углерода и по структуре стали подразделяются на доэвтектоидные 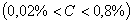 , структура феррит + перлит , структура феррит + перлит 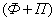 (рис.9.3 а); эвтектоидные (рис.9.3 а); эвтектоидные 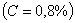 , структура перлит (П), перлит может быть пластинчатый или зернистый (рис. 9.3 б и 9.3 в); заэвтектоидные , структура перлит (П), перлит может быть пластинчатый или зернистый (рис. 9.3 б и 9.3 в); заэвтектоидные 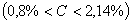 , структура перлит + цементит вторичный (П + ЦII), цементитная сетка располагается вокруг зерен перлита. По микроструктуре сплавов можно приблизительно определить количество углерода в составе сплава, учитывая следующее: количество углерода в перлите составляет 0,8 %, в цементите – 6,67 %. Ввиду малой растворимости углерода в феррите, принимается, что в нем углерода нет. Сплавы железа с углеродом, содержащие углерода более 2,14 % (до 6,67 %), заканчивающие кристаллизацию образованием эвтектики (ледебурита), называют чугунами. Наличие легкоплавкого ледебурита в структуре чугунов повышает их литейные свойства. Чугуны, кристаллизующиеся в соответствии с диаграммой состояния железо – цементит, отличаются высокой хрупкостью. Цвет их излома – серебристо-белый. Такие чугуны называются белыми чугунами. Микроструктуры белых чугунов представлены на рис. 9.4. , структура перлит + цементит вторичный (П + ЦII), цементитная сетка располагается вокруг зерен перлита. По микроструктуре сплавов можно приблизительно определить количество углерода в составе сплава, учитывая следующее: количество углерода в перлите составляет 0,8 %, в цементите – 6,67 %. Ввиду малой растворимости углерода в феррите, принимается, что в нем углерода нет. Сплавы железа с углеродом, содержащие углерода более 2,14 % (до 6,67 %), заканчивающие кристаллизацию образованием эвтектики (ледебурита), называют чугунами. Наличие легкоплавкого ледебурита в структуре чугунов повышает их литейные свойства. Чугуны, кристаллизующиеся в соответствии с диаграммой состояния железо – цементит, отличаются высокой хрупкостью. Цвет их излома – серебристо-белый. Такие чугуны называются белыми чугунами. Микроструктуры белых чугунов представлены на рис. 9.4.  Рис. 9.4. Микроструктуры белых чугунов: а – доэвтектический белый чугун Рис. 9.4. Микроструктуры белых чугунов: а – доэвтектический белый чугун 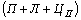 ; б – эвтектический белый чугун (Л); в – заэвтектический белый чугун ; б – эвтектический белый чугун (Л); в – заэвтектический белый чугун 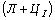 . По количеству углерода и по структуре белые чугуны подразделяются на: доэвтектические . По количеству углерода и по структуре белые чугуны подразделяются на: доэвтектические 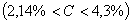 , структура перлит + ледебурит + цементит вторичный , структура перлит + ледебурит + цементит вторичный 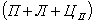 ; эвтектические ; эвтектические 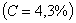 , структура ледебурит (Л) (рис. 9.4 б); заэвтектические , структура ледебурит (Л) (рис. 9.4 б); заэвтектические 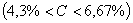 , структура ледебурит + цементит первичный , структура ледебурит + цементит первичный 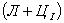 (рис. 9.4 в). В структуре доэвтектических белых чугунов присутствует цементит вторичный, который образуется в результате изменения состава аустенита при охлаждении (по линии ES). В структуре цементит вторичный сливается с цементитом, входящим в состав ледебурита. Фазовый состав сталей и чугунов при нормальных температурах один и тот же, они состоят из феррита и цементита. Однако свойства сталей и белых чугунов значительно различаются. Таким образом, основным фактором, определяющим свойства сплавов системы железо – цементит является их структура. (рис. 9.4 в). В структуре доэвтектических белых чугунов присутствует цементит вторичный, который образуется в результате изменения состава аустенита при охлаждении (по линии ES). В структуре цементит вторичный сливается с цементитом, входящим в состав ледебурита. Фазовый состав сталей и чугунов при нормальных температурах один и тот же, они состоят из феррита и цементита. Однако свойства сталей и белых чугунов значительно различаются. Таким образом, основным фактором, определяющим свойства сплавов системы железо – цементит является их структура.
 Лекция 6 Классификация и маркировка сталей и чугунов. Применение. Лекция 6 Классификация и маркировка сталей и чугунов. Применение.
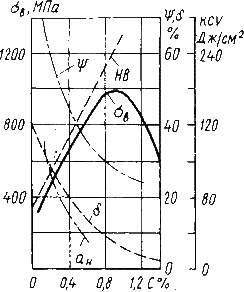 Рис.10.1. Влияние углерода на свойства сталей С ростом содержания углерода в структуре стали увеличивается количество цементита, при одновременном снижении доли феррита. Изменение соотношения между составляющими приводит к уменьшению пластичности, а также к повышению прочности и твердости. Прочность повышается до содержания углерода около 1%, а затем она уменьшается, так как образуется грубая сетка цементита вторичного. Углерод влияет на вязкие свойства. Увеличение содержания углерода повышает порог хладоломкости и снижает ударную вязкость. Повышаются электросопротивление и коэрцитивная сила, снижаются магнитная проницаемость и плотность магнитной индукции. Углерод оказывает влияние и на технологические свойства. Повышение содержания углерода ухудшает литейные свойства стали (используются стали с содержанием углерода до 0,4 %), обрабатываемость давлением и резанием, свариваемость. Следует учитывать, что стали с низким содержанием углерода также плохо обрабатываются резанием. Влияние примесей. В сталях всегда присутствуют примеси, которые делятся на четыре группы. 1. ^ Постоянные примеси: кремний, марганец, сера, фосфор. Марганец и кремний вводятся в процессе выплавки стали для раскисления, они являются технологическими примесями. Содержание марганца не превышает 0,5…0,8 %. Марганец повышает прочность, не снижая пластичности, и резко снижает красноломкость стали, вызванную влиянием серы. Он способствует уменьшению содержания сульфида железа FeS, так как образует с серой соединение сульфид марганца MnS. Частицы сульфида марганца располагаются в виде отдельных включений, которые деформируются и оказываются вытянутыми вдоль направления прокатки. Содержание кремния не превышает 0,35…0,4 %. Кремний, дегазируя металл, повышает плотность слитка. Кремний растворяется в феррите и повышает прочность стали, особенно повышается предел текучести, Рис.10.1. Влияние углерода на свойства сталей С ростом содержания углерода в структуре стали увеличивается количество цементита, при одновременном снижении доли феррита. Изменение соотношения между составляющими приводит к уменьшению пластичности, а также к повышению прочности и твердости. Прочность повышается до содержания углерода около 1%, а затем она уменьшается, так как образуется грубая сетка цементита вторичного. Углерод влияет на вязкие свойства. Увеличение содержания углерода повышает порог хладоломкости и снижает ударную вязкость. Повышаются электросопротивление и коэрцитивная сила, снижаются магнитная проницаемость и плотность магнитной индукции. Углерод оказывает влияние и на технологические свойства. Повышение содержания углерода ухудшает литейные свойства стали (используются стали с содержанием углерода до 0,4 %), обрабатываемость давлением и резанием, свариваемость. Следует учитывать, что стали с низким содержанием углерода также плохо обрабатываются резанием. Влияние примесей. В сталях всегда присутствуют примеси, которые делятся на четыре группы. 1. ^ Постоянные примеси: кремний, марганец, сера, фосфор. Марганец и кремний вводятся в процессе выплавки стали для раскисления, они являются технологическими примесями. Содержание марганца не превышает 0,5…0,8 %. Марганец повышает прочность, не снижая пластичности, и резко снижает красноломкость стали, вызванную влиянием серы. Он способствует уменьшению содержания сульфида железа FeS, так как образует с серой соединение сульфид марганца MnS. Частицы сульфида марганца располагаются в виде отдельных включений, которые деформируются и оказываются вытянутыми вдоль направления прокатки. Содержание кремния не превышает 0,35…0,4 %. Кремний, дегазируя металл, повышает плотность слитка. Кремний растворяется в феррите и повышает прочность стали, особенно повышается предел текучести, 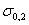 . Но наблюдается некоторое снижение пластичности, что снижает способность стали к вытяжке Содержание фосфора в стали 0,025…0,045 %. Фосфор, растворяясь в феррите, искажает кристаллическую решетку и увеличивает предел прочности . Но наблюдается некоторое снижение пластичности, что снижает способность стали к вытяжке Содержание фосфора в стали 0,025…0,045 %. Фосфор, растворяясь в феррите, искажает кристаллическую решетку и увеличивает предел прочности 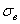 и предел текучести и предел текучести 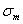 , но снижает пластичность и вязкость. Располагаясь вблизи зерен, увеличивает температуру перехода в хрупкое состояние, вызывает хладоломкость, уменьшает работу распространения трещин, Повышение содержания фосфора на каждую 0,01 % повышает порог хладоломкости на 20…25oС. Фосфор обладает склонностью к ликвации, поэтому в центре слитка отдельные участки имеют резко пониженную вязкость. Для некоторых сталей возможно увеличение содержания фосфора до 0,10…0,15 %, для улучшения обрабатываемости резанием. S – уменьшается пластичность, свариваемость и коррозионная стойкость. Р–искажает кристаллическую решетку. Содержание серы в сталях составляет 0,025…0,06 %. Сера – вредная примесь, попадает в сталь из чугуна. При взаимодействии с железом образует химическое соединение – сульфид серы FeS, которое, в свою очередь, образует с железом легкоплавкую эвтектику с температурой плавления 988oС. При нагреве под прокатку или ковку эвтектика плавится, нарушаются связи между зернами. При деформации в местах расположения эвтектики возникают надрывы и трещины, заготовка разрушается – явление красноломкости. Красноломкость – повышение хрупкости при высоких температурах Сера снижает механические свойства, особенно ударную вязкость а , но снижает пластичность и вязкость. Располагаясь вблизи зерен, увеличивает температуру перехода в хрупкое состояние, вызывает хладоломкость, уменьшает работу распространения трещин, Повышение содержания фосфора на каждую 0,01 % повышает порог хладоломкости на 20…25oС. Фосфор обладает склонностью к ликвации, поэтому в центре слитка отдельные участки имеют резко пониженную вязкость. Для некоторых сталей возможно увеличение содержания фосфора до 0,10…0,15 %, для улучшения обрабатываемости резанием. S – уменьшается пластичность, свариваемость и коррозионная стойкость. Р–искажает кристаллическую решетку. Содержание серы в сталях составляет 0,025…0,06 %. Сера – вредная примесь, попадает в сталь из чугуна. При взаимодействии с железом образует химическое соединение – сульфид серы FeS, которое, в свою очередь, образует с железом легкоплавкую эвтектику с температурой плавления 988oС. При нагреве под прокатку или ковку эвтектика плавится, нарушаются связи между зернами. При деформации в местах расположения эвтектики возникают надрывы и трещины, заготовка разрушается – явление красноломкости. Красноломкость – повышение хрупкости при высоких температурах Сера снижает механические свойства, особенно ударную вязкость а 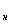 и пластичность ( и пластичность (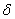 и и 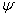 ), а так же предел выносливости. Она ухудшают свариваемость и коррозионную стойкость. 2. ^ Скрытые примеси - газы (азот, кислород, водород) – попадают в сталь при выплавке. Азот и кислород находятся в стали в виде хрупких неметаллических включений: окислов (FeO, SiO2, Al2O3) нитридов (Fe 2N), в виде твердого раствора или в свободном состоянии, располагаясь в дефектах (раковинах, трещинах). Примеси внедрения (азот N, кислород О) повышают порог хладоломкости и снижают сопротивление хрупкому разрушению. Неметаллические включения (окислы, нитриды), являясь концентраторами напряжений, могут значительно понизить предел выносливости и вязкость. Очень вредным является растворенный в стали водород, который значительно охрупчивает сталь. Он приводит к образованию в катанных заготовках и поковках флокенов.Флокены – тонкие трещины овальной или округлой формы, имеющие в изломе вид пятен – хлопьев серебристого цвета. Металл с флокенами нельзя использовать в промышленности, при сварке образуются холодные трещины в наплавленном и основном металле. Если водород находится в поверхностном слое, то он удаляется в результате нагрева при 150…180 ), а так же предел выносливости. Она ухудшают свариваемость и коррозионную стойкость. 2. ^ Скрытые примеси - газы (азот, кислород, водород) – попадают в сталь при выплавке. Азот и кислород находятся в стали в виде хрупких неметаллических включений: окислов (FeO, SiO2, Al2O3) нитридов (Fe 2N), в виде твердого раствора или в свободном состоянии, располагаясь в дефектах (раковинах, трещинах). Примеси внедрения (азот N, кислород О) повышают порог хладоломкости и снижают сопротивление хрупкому разрушению. Неметаллические включения (окислы, нитриды), являясь концентраторами напряжений, могут значительно понизить предел выносливости и вязкость. Очень вредным является растворенный в стали водород, который значительно охрупчивает сталь. Он приводит к образованию в катанных заготовках и поковках флокенов.Флокены – тонкие трещины овальной или округлой формы, имеющие в изломе вид пятен – хлопьев серебристого цвета. Металл с флокенами нельзя использовать в промышленности, при сварке образуются холодные трещины в наплавленном и основном металле. Если водород находится в поверхностном слое, то он удаляется в результате нагрева при 150…180 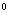 , лучше в вакууме , лучше в вакууме 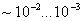 мм рт. ст. Для удаления скрытых примесей используют вакуумирование. 3. ^ Специальные примеси – специально вводятся в сталь для получения заданных свойств. Примеси называются легирующими элементами, а стали - легированные сталями. Классификация и маркировка сталей Классификация сталей Стали классифицируются по множеству признаков. мм рт. ст. Для удаления скрытых примесей используют вакуумирование. 3. ^ Специальные примеси – специально вводятся в сталь для получения заданных свойств. Примеси называются легирующими элементами, а стали - легированные сталями. Классификация и маркировка сталей Классификация сталей Стали классифицируются по множеству признаков.
|
1 2 3 4 5 6 7 8 9... 25
Лекция 7 ^ Классификация и маркировка легированных сталей. Применение. Влияние легирующих элементов на равновесную структуру сталей. План:
 Сейчас читают про:
|
 2015-05-26
2015-05-26 2336
2336

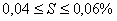 ,
, 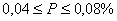 – углеродистые стали обыкновенного качества:
– углеродистые стали обыкновенного качества: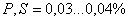 – качественные стали;
– качественные стали;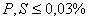 –
– 





