РАВНОВЕСИЯ В РАСТВОРАХ ЭЛЕКТРОЛИТОВ
Электролиты – химические вещества и системы, в которых прохождение электрического тока осуществляется за счет движения ионов. Такие проводники относятся к проводникам второго рода. Наличие свободных ионов объясняется явлением диссоциации (ионизации) – распадом молекул на ионы: а) при образовании растворов - под действием полярных молекул растворителя (электролитическая диссоциация); б) при образовании расплавов - в результате термического распада (термическая диссоциация). В зависимости от степени электролитической диссоциации a = n/N, (где n – число распавшихся молекул, N-исходное число растворенных молекул) электролиты подразделяются на сильные (a»1), слабые (a < 0,03) и средней силы (0,03 < a <0,3). Степень диссоциации зависит от концентрации электролита (чем больше концентрация – тем меньше степень диссоциации). Для расчетов пользуются не концентрацией электролита, а его эффективной концентрацией – активностью (а) а = f•Cм. В этом уравнении f-коэффициент активности (определяется экспериментально) учитывает отклонение активности от концентрации. Для разбавленных растворов слабых электролитов f можно считать равным единице и для расчетов можно использовать концентрацию – См.
Диссоциация кислот, оснований
Согласно теории электролитической диссоциации Аррениуса, кислотой называется вещество, которое при диссоциации отщепляет свободные ионы водорода Н+, а основанием – вещество, которое при
диссоциации отщепляет свободные ионы гидроксида ОН-. Основания, образованные щелочными металлами (Li, Na, K и т.д.), являются сильными электролитами (a»1) и называются щелочами. Диссоциация кислот и оснований протекает ступенчато: последовательно отщепляется ион Н+ (или ОН -), т.е. число ступеней зависит от основности кислоты (числа атомов Н в молекуле) или от кислотности основания (числа гидроксидных групп ОН -). Например: диссоциация Н3РО4 протекает в три ступени:
I Н3РО4 ⇄ Н+ + Н2РО4- a 1 < 1;
II Н2РО4 - ⇄ Н+ + НРО42-, a 2 <a 1;
III НРО42- ⇄ Н+ + РО43-, a 3 <a 2 <a 1;
а Zn(OH)2 в две ступени:
I Zn(OH)2 ⇄ ZnOH+ +OH -; II ZnOH+ ⇄ Zn2++ OH -
Процесс диссоциации солей определяется типом соли: средние соли распадаются одноступенчато, диссоциация кислых и основных определяется «остатком» кислоты (или основания) в составе соли. Например, основная соль MgOHCl диссоциирует в 2 ступени:
I. MgOHCl ⇄ MgOH+ + Cl -, a =1; II. MgOH+ ⇄ Mg2+ + OH - a <1.
Обратимый процесс диссоциации слабых электролитов характеризуется константой диссоциации Кд. Например, для слабой уксусной кислоты, процесс диссоциации которой идет в соответствии с уравнением CH3COOH ⇄ H+ + CH3COO -,
Кд = 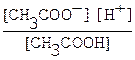 . В зависимости от величины Кд
. В зависимости от величины Кд
электролиты подразделяются на сильные (Кд > 10-3) и слабые (Кд < 10 -3). Кд зависит только от природы электролита и температуры и является табличной величиной.
Для слабых электролитов бинарного типа (распадаются на один катион и один анион) взаимосвязь между исходной концентрацией растворенного вещества (молярностью См), концентрациями ионов, нераспавшихся молекул, степенью и константой диссоциации выражается законом разведения (разбавления) Оствальда:
Реакция диссоциации АВ ⇄ А+ + В-
Концентрации ионов в растворе [A+] = [B-] = a Cм
Концентрация нераспавшихся молекул [AB] = (1- a) Cм
Уравнение Оствальда для слабых (ά→0, Кд <10- 4) электролитов Кд = a 2См
 2015-05-26
2015-05-26 4507
4507