ОПРЕДЕЛЕНИЕ ЖЕСТКОСТИ ВОДЫ.
Жесткость воды обусловлена присутствием в ней растворимых кальциевых и магниевых солей различных кислот (угольной, серной, соляной, азотной, фосфорной и кремниевой).
Жесткость воды бывает карбонатная и некарбонатная.
Карбонатная жесткость обусловлена присутствием в воде, гидрокарбонатов кальцияи магния и называется временной, потому что ее можно почти полностью устранить кипячением. Гидрокарбонаты при этом подвергаются разложению с образованием углекислоты и выпадающих в осадок карбонатов.
Некарбонатная жесткость обусловлена присутствием кальциевых и магниевых солей серной, соляной, азотной, фосфорной и кремниевой кислот, которые при кипячении остаются в растворе.
Жесткость воды подразделяют на кальциевую и магниевую.
Жесткость выражают в миллиграм-эквивалентах растворимых солей кальция и магния на литр. До издания ГОСТа 6055-51 жесткость воды выражали в градусах. Одному немецкому градусу жесткости соответствует жесткость раствора, в литре которого растворено 10 мг СаО или 7,8 мг MgO.
Одному миллиграмм-эквиваленту жесткости соответствует 2,801 мг-экв. составляет 20,04 мг Са2+ или 12,16 Мg2+ в 1 л воды.
По жесткости воду можно подразделить на:
-очень мягкую /от 0 до 1,5 мг-экв/л/;
-мягкую /от 1,5 до 3 мг-экв/л/;
-средней жесткости /от 3 до 4,5 мг-экв/л/;
-довольно жесткую /от 4,5 до 6,6 мг-экв/л /;
-жесткую /от 6,5 до 11 мг-экв/л /;
-очень жесткую /свыше 11 мг-экв/л/.
По ГОСТу 2974-54 допустимой жесткостью для хозяйственно-питьевого водоснабжения считается жесткость не более 7мг-экв/л /до 0°/.
Соли, обуславливающие жесткость, не являются вредными для организма, однако, присутствие их в воде в больших количествах нежелательно, т.к. они делают воду не пригодной для хозяйственно-бытовых нужд. В жесткой воде плохо развариваются овощи, перерасходуется мыло при стиркe белья, сокращается срок службытканей, выпадают осадки в водопроводных трубах и т.д. Вода, содержащая такие соли, совершенно непригодна для паровых котлов из-за образования плотных слоев накипи, приводящей к перегреву котла и способствующей его быстрому разрушению. Поэтому воду, которая используется для питания паросиловых установок, а также ТЭЦ, подвергают специальному умягчению. Вода с повышенной карбонатной жесткостью непригодна для охлаждения. Охлаждая теплообменную аппаратуру, вода нагревается. При нагревании происходит разложение гидрокарбонатов кальция и выпадение, карбонатов, осадки которых забивают теплообменник. Присутствие солей некарбонатной жесткости в воде, используемойдля охлаждения, не представляет такой опасности.
1.ОПРЕДЕЛЕНИЕ ОБЩЕЙ ЩЕЛОЧНОСТИ И КАРБОНАТНОЙ
ЖЕСТКОСТИ ВОДЫ
Определение общей щелочности основано на реакции образования нейтральных солей при титровании воды соляной кислотой. Общая щелочность воды обусловлена присутствием в ней ионов 0Н-, СО32- и НСО3-.
Ионы ОН- и СО32- титруются соляной кислотой в присутствии индикатора фенолфталеина (при рН=8,3) и обусловливает щелочность воды по фенолфталеину. При титровании воды соляной кислотой в присутствии фенолфталеина протекают следующие реакции:
ОН- + Н+ = Н2О
СО32- + Н+ = НСО3-
Ионы НСО3- титруются соляной кислотой в присутствии индикатора метилового оранжевого /при рН=3,6/. Протекающую при этом реакцию можно выразить уравнением:
НС03- + Н+ = СО2 + Н2О
Если щелочность по фенолфталеину равна нулю, то общая щелочность воды обусловлена присутствием в ней только гидрокарбонатов / НС03- /.
В большинстве природных вод ионы НС03- связаны только с ионами Са2+ и Мg2+.Поэтому в тех случаях, когда щелочность по фенолфталеину равна нулю, можно считать, что общая щелочность воды равна ее карбонатной жесткости.
Ход определения
К 10 мл исследуемой пробы воды, отмеренной пипеткой в коническую колбу на 250 мл, добавляют 50 мл дистиллированной воды и 2-3 капли pacтвора фенолфталеина.
Если появится розовая окраска, то воду титруют 0,1 н раствором соляной кислоты до обесцвечивания. Затем в ту же колбу добавляет 2-3 капли раствора метилового оранжевого и продолжают титрование 0,1 н раствором соляной кислоты до перехода окраски из желтой в розовую. Записывают объем 0,1 н раствора соляной кислоты, израсходованный на титрование с фенолфталеином и общий объем 0,1 н раствора соляной кислоты, израсходованный на все титрование.
Общую щелочность /Щоб./ воды в мг-экв/л вычисляют по формуле:
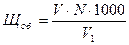 ,
,
где V- общий объем раствора соляной кислоты, израсходованный на
титрование взятого объема исследуемой воды, мл.
V1 - объем воды, взятой для исследования, мл.
N - нормальность раствора соляной кислоты.
Для расчета некарбонатной /постоянной/ жесткости дополнительно определяют щелочность исследуемой воды по фенолфталеину /Щф./ мг-экв/, которую рассчитывают по формуле:
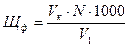 ,
,
где Vk - объем раствора соляной кислоты, израсходованной на титрование, мл.
Если oелочность по фенолфталеину равна нулю, то общая щелочность равна карбонатной жесткости. Некарбонатную /постоянную/ жесткость определяют как разницу между общей жесткостью и карбонатной жесткостью.
2.ОПРЕДЕЛЕНИЕ ОБЩЕЙ ЖЕСТКОСТИ ВОДЫ
КОМПЛЕКСОМЕТРИЧЕСКИМ МЕТОДОМ
(ПРИ ПОМОЩИ ТРИЛОНА Б)
Комплексометрический метод определения общей жесткости основан на том, что ионы кальция и магния связываются трилоном Б в комплексные е соединения.
Формула трилона Б (Н2ЭДТА2-):
Ме2+ + Н2ЭДТА2- = МеЭДТА2- + 2Н+,
где Ме2+ = Са2+ и Мg2+.
Определению общей жесткости воды мешают: медь, цинк, марганец и высокое содержание углекислых солей.
Влияние мешающих веществ устраняется в ходе анализа
.
В коническую колбу вносят 100 мл отфильтрованной испытуемой воды или меньший объем, разбавленный до 100 мл дистиллированной водой.
При этом суммарное содержание ионов кальция и магния во взятом обьеме воды не должно превышать 0,5 мг-экв.
Затем прибавляют 5 мл буферного раствора, 5-7 капель индикатора или приблизительно 0,1 г сухой смеси индикатора хромоген черного с сухим хлористым натрием и сразу же титруют при сильном взбалтывании 0,05 н раствором трилона Б до изменения окраски в эквивалентной точке (окраска должна быть синей с зеленым оттенком).
Если на титрование расходуется больше 10 мл 0,05 н раствора трилона Б, то это указывает, что в отмеренном объеме воды суммарное содержание ионов кальция и магния больше 0,5 мг-экв. В этом случае следует определение повторить, взяв меньший обьем воды и разбавив его до 100 мл дистиллированной водой.
Нечетное изменение окраски в эквивалентной точке указывает на присутствие меди и цинка. Для устранения влияния мешающих ионов к отмеренной для титрования пробе воды необходимо прибавить 1-2 мл 5% раствора сульфида натрия, после чего провести титрование, как указано выше.
Если после прибавления к отмеренному объему воды буферного раствора и индикатора раствор обесцвечивается, приобретая серый цвет, это указывает на присутствие марганца.
В таком случае в воду до внесения реактивов следует добавить 5 капель 1% раствора солянокислого гидроксиламина и далее определять жесткость как указано выше.
Если титрование не дает четкой точки эквивалентности /при высокой щелочности воды,/ то к воде прибавляют 0,1н раствор соляной кислоты в количестве, необходимом для нейтрализации щелочности воды, с последующим кипячением в течение 5 мин.
Общую жесткость раствора /Жоб/ в мг-экв/л рассчитывают по формуле:
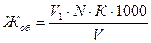 ,
,
где V1 - объем раствора трилона Б, израсходованный на титрование исследуемой воды, мл.
N - нормальность раствора трилона Б.
V - объем исследуемой пробы воды, мл.
К - поправочный коэффициент к нормальности раствора трилона Б.
Приготовление аммиачного буферного раствора: к 20 г хлорида аммония приливают 100 мл 20%-го раствора аммиака и доводят общий объем раствора до 1 л.
Приготовление спиртового раствора индикатора эриохром черного Т: к 0,5 г индикатора приливают 10 мл аммиачного буферного раствора и доводят общий объем раствора этиловым спиртом до 100 мл.
Результаты определения щелочности и жесткости воды записывают в виде таблицы 4.
Таблица 4.
| Место отбора пробы | Щелочность по фенол фталеину | Общая щелоч- ность, мг-экв/л | Общая жесткость, мг-экв/л | Некарбонат-ная жест-кость, мг-экв/л | Приме-чание |
3.ОПРЕДЕЛЕНИЕ КАЛЬЦИЕВОЙ И МАГНИЕВОЙ
ЖЕСГКОСТИ ВОДЫ (ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ ИОНОВ Са2+И Мg2+ КОМПЛЕКСОНОМЕТРИЧЕСКИМ МЕТОДОМ).
Сначала определяют общую жесткость воды по методике, описанной ранее. Потом осаждают ионы: кальция в виде осадка оксалата кальция Са2СО4:
СаСI2 + (NH4)2C2O4 = СаС2О4 + 2NH4СI,
а в фильтрате определяют магниевую жесткость. Кальциевую жесткость определяют как разность между общей и магниевой жесткостью.
Ход определения.
К 10мл исследуемой воды, отмеренной пипеткой в коническую колбу емкостью 250 мл, приливают 1 мл специального буферного раствора и 10-15 мл 50%-го раствора оксалата аммония, добавляют 50 мл дистиллированной воды. При этом выпадает осадок оксалата кальция - СаС2О4, который отфильтровывают через плотный беззольный фильтр. Осадок на фильтре промывают 2 раза небольшим количеством холодной дистиллированной воды. Промывные воды присоединяют к фильтрату и определяют жесткость: к раствору приливают 5 мл аммиачного буферного раствора, 6-7 капель раствора индикатора эриохром черного Т и титруют 0,05 н раствором трилона Б.
Магниевую жесткость ЖMg (мг-экв/л) вычисляют по Формуле:
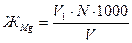 ,
,
где V1 - объем раствора трилона Б, израсходованный на титрование, мл;
V- объем исследуемой воды, мл;
N - нормальность раствора трилона Б.
Кальциевую жесткость ЖСа вычисляют по формуле:
ЖСа = Жоб. – ЖMg
Содержание ионов Са2+ / X1/ вычисляют по формуле:
X1 = 20,04 · ЖСа , мг/л.
Содержание ионов Mg2+ вычисляют по формуле:
Х2 – 12,16 · ЖMg, мг/л,
где 20,04 и 12,16 - грамм-эквиваленты кальция и магния.
Приготовление специального буферного раствора: к 67,5 г хлорида аммония приливают 570мл 25%-ного аммиака и доводят дистиллированной водой до 1л.
Результаты определений кальциевой и магниевой жесткости записывают в виде таблицы 5.
Таблица 5
| Место отбора пробы | Содержа-ние Са2+, мг/л | Содержа-ние Mg2+, мг/л | Кальциевая жесткость, мг-экв/л | Магниевая жесткость, мг-экв/л |
 2015-05-26
2015-05-26 2223
2223








