Наряду с рассмотренными положительными сторонами теория Аррениуса имеет два существен-ных недостатка.
Первый недостаток связан с тем, что данная теория игнорирует взаимодействие ионов с диполя-ми воды или другого растворителя, т. е. ион-дипольное взаимодействие. Между тем именно это взаимодействие, как показано далее, является физической основой образования ионов при растворении электролита. Таким образом, без учета ион-дипольного взаимодействия нельзя было объяснить процесс образования ионов и устойчи-вость ионных систем. Вопрос о причинах электро-литической диссоциации вскрывает наиболее уязви-мые места теории Аррениуса.
Второй недостаток теории Аррениуса связан с игнорированием ион-ионного взаимодействия. Ионы рассматривались как частицы идеального га-за, а следовательно, не учитывались обусловленные кулоновскими силами притяжения катионов и анионов и отталкивание одноименно заряженных ионов. Пренебрежение ион-ионным взаимодейс-твием, совершенно непонятное с физической точки зрения, приводило к нарушению количественных соотношений теории Аррениуса. Так, например, строгая проверка уравнения (1.2.2) показывала, что константа диссоциации К не остается постоянной, а изменяется при изменении концентрации электролита. Наиболее отчетливо этот эффект проявляется в растворах сильных электролитов, истинная степень диссоциации которых близка к единице (так называемая «аномалия сильных электролитов»). Но даже в растворах слабой уксусной кислоты зависимость К от концентрации СН3СООН значительно превосходит возможные ошибки измерений. Ниже приведены константы диссоциации К для водных растворов КNО3 и СН3СООН при 25 0С:
СKNO  , M , M
| 0.005 | 0,01 | 0,02 | 0,1 |
 ,M ,M
| 1,42 | 1,38 | 1,57 | 2,14 |
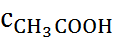 , M , M
| 0,001 | 0,02 | 0,1 | 0,2 |
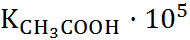 , M , M
| 1,751 | 1,740 | 1,700 
| 1,653 |
 Нарушения количественных соотношений теории Аррениуса вследствие ион-ионного взаимо-действия проявляется также в том, что различные методы определения степени диссоциации α дают несовпадающие результаты. Так, α можно рассчитать по уравнению (1.2.1), зная изотонический коэффициент Вант-Гоффа. Далее, поскольку электропроводность раствора зависит от концентрации свободных ионов и, следовательно, от степени диссоциации,
Нарушения количественных соотношений теории Аррениуса вследствие ион-ионного взаимо-действия проявляется также в том, что различные методы определения степени диссоциации α дают несовпадающие результаты. Так, α можно рассчитать по уравнению (1.2.1), зная изотонический коэффициент Вант-Гоффа. Далее, поскольку электропроводность раствора зависит от концентрации свободных ионов и, следовательно, от степени диссоциации, 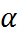 можно определить из измерений электропроводности. Наконец, как сле-дует из электрохимической термодинамики, раз-ность потенциалов на концах равновесной электро-химической цепи связана с концентрацией ионов, участвующих в установлении электрохимического равновесия. Поэтому иногда степень диссоциации α можно рассчитать по величине разности потен-циалов соответствующей цепи. Расхождения в значениях α, рассчитанных тремя указанными методами, оказывается весьма существенными, особенно для растворов сильных электролитов. Для концентрированных растворов сильных электроли-тов последний метод иногда приводит к не имею-щим физического смысла значениям α > 1.
можно определить из измерений электропроводности. Наконец, как сле-дует из электрохимической термодинамики, раз-ность потенциалов на концах равновесной электро-химической цепи связана с концентрацией ионов, участвующих в установлении электрохимического равновесия. Поэтому иногда степень диссоциации α можно рассчитать по величине разности потен-циалов соответствующей цепи. Расхождения в значениях α, рассчитанных тремя указанными методами, оказывается весьма существенными, особенно для растворов сильных электролитов. Для концентрированных растворов сильных электроли-тов последний метод иногда приводит к не имею-щим физического смысла значениям α > 1.
Если в раствор ввести большой избыток посто-роннего электролита (так называемого «фона»), который не участвует непосредственно в ионных равновесиях, то в этих условиях основные соотно-шения теории Аррениуса выполняются с очень хорошей степенью приближения. Метод введения избытка был предложен Я. Брёнстедом и получил название метода постоянной ионной среды.
Игнорирование взаимодействия частиц раство-ренного вещества между собой и с молекулами растворителя являлось основным объектом критики теории Аррениуса. В частности, в противопо-ложность С. Аррениусу и Я. Вант-Гоффу, которые рассматривали растворы, как механическую смесь молекул воды с молекулами и ионами электролита, Д.И. Менделеев говорил о химическом взаимодей-ствии между растворенным веществом и раство-рителем, за счет которого образуются «жидкие непрочные соединения в состоянии диссоциации».
Идеи о взаимодействии ионов с растворителем как о причине диссоциации высказывали И.А. Каб-луков, В.А. Кистяковский, А. Вернер и другие уче-ные. Постепенно выкристаллизовывалось фундаме-нтальное понятие о сольватации как о причине образования и стабильности ионов в растворе. Позднее сольватацию стали разделять на первич-ную и вторичную. Первичная сольватация опреде-ляется прочным связыванием ионом молекул растворителя и характеризуется числом сольвата-ции, т.е. числом молекул растворителя, непосредс-твенно связанным с ионом. Вторичная сольватация (её характеризуют, соответственно, числом вторич-ной сольватации) является результатом электрос-татического взаимодействия ионов и молекул растворителя, приводящего к некоторой разупоря-доченности в расположении последних. Было выс-казано предположение об образовании в растворах электролитов ионных пар и более сложных анион-катионных ассоциатов, отличных от недиссо-циированных молекул растворяемого вещества. Попытки количественно учесть ион-дипольное и ион-ионное взаимодействие неоднократно предпри-нималось начиная с 30-х годов ХХ столетия и привело к формированию современных теорий растворов электролитов
 2015-05-26
2015-05-26 492
492







