Жидкости в ближнем порядке имеют упорядоченное строение, то есть в них создаются полиэдрические структуры среднестатистического строения (тетраэдры, тригональные бипирамиды, октаэдры и др.) При растворении газов в жидкостях образуются разнородные по составу полиэдры, в которых молекулы растворённого газа могут быть окружены в первой координационной сфере молекулами растворителя с образованием тетраэдров, тригональных бипирамид, октаэдры и других, также среднестатистической структуры.
Полиэдры, включающие молекулу растворённого газа и молекулы растворителя (лиганды) в первой и последующей координационной сферах непрерывно обмениваются лигандами с молекулами растворителя из объёма. Поэтому структура полиэдров может существовать в растворе как среднестатистическая пространственная структура.
В механизме процесса растворения газа в жидкости можно выделить следующие стадии:
· диффузия молекул газа из объёма к поверхности жидкости;
· соударение молекул газа с поверхностью жидкости;
· разрушение полиэдров жидкости в поверхностном слое молекулами газа, с поглощением энергии;
· взаимодействие молекул газа с молекулами жидкости в объёме;
· образование новых полиэдров разнородного состава, с выделением энергии в объём жидкости;
· координация молекул газа с молекулами жидкости с образованием первой и других координационных сфер вокруг молекул газа в составе полиэдров;
· диффузия полиэдров в объём или эстафетная передача молекул газа от полиэдра к полиэдру.
Первые две стадии требуют затраты небольшой энергии, а стадии по синтезу разнородного по составу полиэдра сопровождается выделением энергии в форме теплоты.
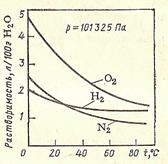 Поэтому при обычных давлениях растворение газа в жидкости является экзотермическим процессом (протекает с выделением теплоты) и, в соответствии с правилом Ле Шателье–Брауна, с повышением температуры равновесие смещается в сторону эндотермического процесса, а следовательно количество растворённого газа в жидкости будет уменьшаться, что показано на рисунках 1–2 и в таблицах 1–2.
Поэтому при обычных давлениях растворение газа в жидкости является экзотермическим процессом (протекает с выделением теплоты) и, в соответствии с правилом Ле Шателье–Брауна, с повышением температуры равновесие смещается в сторону эндотермического процесса, а следовательно количество растворённого газа в жидкости будет уменьшаться, что показано на рисунках 1–2 и в таблицах 1–2.
Рис. 2 - Зависимость растворимости газов в воде от температуры
Растворимость кислорода в воде примерно в два раза выше, чем азота (рис. 2), поэтому воздух, растворённый в воде, примерно в два раза более богат кислородом, чем воздух атмосферы. Если между газом и растворителем нет химического взаимодействия, то обычно концентрация растворённого газа небольшая (табл. 1).
Таблица 4.1 – Коэффициент растворимости кислорода в воде при разных температурах
| Температура, К | Коэффициент растворимости (a), г/100 г |
| 0,04889 | |
| 0.03103 | |
| 0,01946 | |
| 0,01720 |
Некоторые газы, например, аммиак (табл. 2), взаимодействуют с водой и растворимость их в воде велика
Таблица 2 – Растворимость аммиака в воде при разных температурах
| Температура, К | Коэффициент растворимости (a), г/л |
Растворимость углеводородов при разных давлениях в воде от температуры меняется по кривым с минимумом.
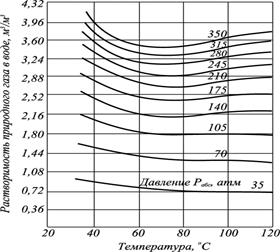 Рис. 2 - Зависимость растворимости природного газа в пресной воде от температуры при различных давлениях
Рис. 2 - Зависимость растворимости природного газа в пресной воде от температуры при различных давлениях
С увеличением температуры растворимость углеводородов в воде уменьшается (рис. 21), достигает минимума, а затем снова возрастает.
Из приведённых выше рисунков и таблиц видно, что растворимость газа в жидкости с повышением температуры снижается.
Аналитическую зависимость растворимости газа в жидкостях от температуры можно получить методом сравнения химических потенциалов газа, находящегося над жидкостью и в растворе. Пусть в термостатированной системе "газ–жидкость" при р, Т = const газ в растворе и над поверхностью раствора находится в равновесии, как показано на рисунке 4.3.
 Рис. 4.3 - Равновесие в системе газ-жидкость
Рис. 4.3 - Равновесие в системе газ-жидкость
Равновесие в термостатированной системе характеризуется равенством химических потенциалов газа в газовой (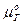 ) и жидкой (
) и жидкой (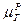 ) фазах:
) фазах:
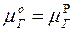 . (20)
. (20)
Химический потенциал для газовой фазы зависит только от температуры: 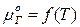 , а для раствора от температуры и от мольной доли газа в растворе (х2):
, а для раствора от температуры и от мольной доли газа в растворе (х2): 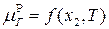 , то есть выражение (20) будет выглядеть следующим образом:
, то есть выражение (20) будет выглядеть следующим образом:
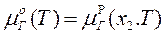 . (21)
. (21)
Дифференцируя выражение (21) по Т и х2, получим:
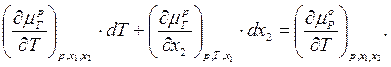 (22)
(22)
Химический потенциал газа в растворе определяется по формуле: 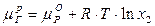 , и производная от этого выражения будет вида:
, и производная от этого выражения будет вида:
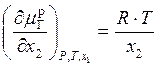 . (23)
. (23)
Производные по температуре можно расшифровать и записать в таком виде:

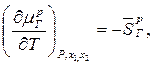
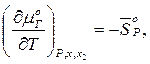 (24)
(24)
где 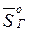 и
и 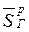 – парциальные мольные энтропии газа над жидкостью и газа в растворе, соответственно.
– парциальные мольные энтропии газа над жидкостью и газа в растворе, соответственно.
Подставив (24) в (22), получим:
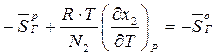 . (25)
. (25)
Откуда
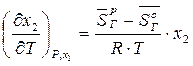 . (26)
. (26)
По 2-му закону термодинамики разность энтропий для термодинамически обратимого процесса растворения газа в жидкости будет равна теплоте его растворения, делённой на температуру (приведённая теплота):
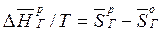 . (27)
. (27)
Подставив (27) в (26), получим логарифмическую зависимость растворимости газа от температуры:
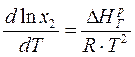 . (29)
. (29)
Для процесса растворения газа в жидкости при обычных условиях
∆НрГ < 0 (экзотермический процесс идёт с выделением теплоты), поэтому 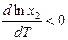 и с повышением температуры растворимость газа в жидкости уменьшается в области невысоких температур (рис. 2). В области высоких температур величина
и с повышением температуры растворимость газа в жидкости уменьшается в области невысоких температур (рис. 2). В области высоких температур величина 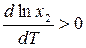 и
и
 2015-05-26
2015-05-26 1713
1713
