Организм человека поддерживает постоянство внутренней среды – гомеостаз. Кислотно-основной гомеостаз означает постоянное значение рН биологических жидкостей: плазма крови – 7,4±0,05; эритроциты – 7,25; желудочный сок – 0,9¸1,1; поджелудочная железа – 7,5¸7,8. Постоянное значение рН необходимо для функционирования ферментов и гормонов, которые проявляют активность только в узком интервале рН (пепсин рН 1, амилаза рН 6,7, трипсин 7,5¸8), для поддержания осмотического гомеостаза, для обеспечения каталитического действия ионов Н+.
Особенно важно поддержание постоянства рН крови. Отклонение рН плазмы крови на 0,4 ед. может за собой летальный исход. Отклонение рН в кислотную область называют ацидозом, в щелочную – алкалозом.
Поддержание постоянного уровня рН в крови и тканевых жидкостях достигается с помощью регуляторных механизмов, включающих несколько буферных систем. Основными буферными системами крови являются следующие.
1. Гидрокарбонатная буферная система, характеризующаяся равновесием молекул слабой угольной кислоты с образующимися при ее диссоциации гидрокарбонат-ионами:
H2CO3 = H+ + HCO3-
В организме угольная кислота возникает в результате гидратации диокида углерода – продукта окисления углеводов, белков и жиров.
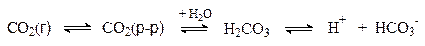
При ацидозе это равновесие смещается влево и избыток СО2 через легкие выводится из организма. Ацидоз может быть вызван, например, образованием в мышцах избытка молочной кислоты при интенсивной физической нагрузке.
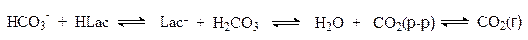
Ацидоз возникает также в душных помещениях при избытке в воздухе СО2.
рН гидрокарбонатного буфера определяется уравнением:
рН = pKa1(H2CO3) + lg 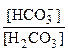
Для поддержания нормального значения рН плазмы крови 7,4, соотношение 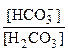 должно быть равно11,2. Так как концентрация гидрокарбонат-ионов в крови существенно выше, буферная емкость гидрокарбонатного буфера в крови по кислоте (40 ммоль/л) значительно больше, чем по щелочи (1-2ммоль/л).
должно быть равно11,2. Так как концентрация гидрокарбонат-ионов в крови существенно выше, буферная емкость гидрокарбонатного буфера в крови по кислоте (40 ммоль/л) значительно больше, чем по щелочи (1-2ммоль/л).
1. Фосфатная буферная система характеризуется равновесием между гидрофосфат- и дигидрофосфат-ионами:
H2PO4- = HPO42- + H+
и обусловлена присутствием в основном неорганических фосфатов.
Эта буферная система играет важную роль в поддержании постоянства рН крови, особенно внутриклеточной жидкости эритроцитов. рН фосфатного буфера рассчитывается по формуле:
рН = pKa2(H3PO4) + lg 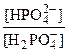
и соотношение 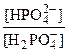 в плазме крови (рН 7,4) составляет 1,6.
в плазме крови (рН 7,4) составляет 1,6.
Буферная емкость фосфатной буферной системы ниже, чем гидрокарбонатной: по кислоте – 1-2 ммоль/л, по щелочи – 0,5 ммоль/л.
 2015-05-26
2015-05-26 3256
3256
