7.1 Теория электролитической диссоциации
Электролитами называются вещества, которые при растворении в какой- либо среде распадаются на ионы независимо от того пропускается ли через систему электрический ток или нет. К электролитам относятся кислоты, основания и большинство неорганических и органических солей. Самопроизвольный процесс распада электролита в растворах на ионы называется электролитической диссоциацией. Впервые теория диссоциации была сформулирована в 1887 голу шведским химиком Сванте Аррениусом. Эта теория, получившая название классической теории диссоциации электролитов, состоит из следующих основных положений:
1) Молекулы кислот, оснований и солей при растворении самопроизвольно диссоциируют на ионы. При этом ионы ведут себя как молекулы идеального газа, т. е. не взаимодействуют между собой.
2) Не весь электролит, а только его часть распадается на ионы. Остальная его часть находится в растворе в недиссоциированном состоянии. Доля электролита, которая распадается на ионы, называется степенью диссоциации электролита.
3) К процессу электролитической диссоциации применим закон действующих масс.
Рассмотрим процесс диссоциации одно-однозарядного электролита:
KtAn = Kt+ + An- (7.1)
Если концентрация электролита в растворе С и степень его диссоциации α, количество распавшегося на ионы электролита составит Сα. Тогда концентрация катионов и анионов
в растворе составит Сα, а концентрация непродиссоциирующего элекролита составит С – Сα. Уравнение закона действующих масс для реакции (1) выражается уравнением:
К = 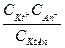 =
= 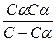 , (7.2)
, (7.2)
где К – константа равновесия или константа диссоциации электролита.
После преобразования получим:
K = 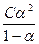 (7.3)
(7.3)
Поскольку константа равновесия К зависит только от температуры, то можно заключить, что при разведении (уменьшении концентрации) электролита степень его диссоциации увеличивается. Разведением называют объём электролита, в котором содержится один грамм- эквивалент электролита, т. е.
V = 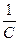 , (7.4)
, (7.4)
где V – разведение, л/г-экв.
Тогда уравнение (7.3) можно представить в виде:
К = 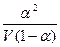 (7.5)
(7.5)
Уравнения (7.3) и (7.5) часто называют законом разведения Оствальда.
В результате процесса диссоциации в растворе электролитов увеличивается число частиц. Это увеличение характеризует изотонический коэффициент Вант - Гоффа. Общее число частиц в единице объёма раствора для электролита с концентрацией С и степенью диссоциации α, распадающегося при диссоциации на k ионов, составит:
(С – Сα) + Сkα = С[1 – α(k – 1)] = iC, (7.6)
где i = 1 – α(k – 1) – изотонический коэффициент, который всегда больше единицы(i > 1).
Тогда для степени диссоциации электролита можно записать:
α = 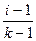 (7.7)
(7.7)
Все электролиты могут быть разделены на две группы: сильные и слабые.
Сильные электролиты – это вещества, которые даже в относительно концентрированных растворах полностью диссоциированы на ионы. К ним относятся неорганические кислоты и основания (HCl, HNO3, H2SO4, NaOH, KOH и др.), большинство растворимых солей неорганических кислот.
К слабым относятся электролиты, которые характеризуются малой степенью диссоциации. Для них она составляет не более 5%. К слабым электролитам относятся некоторые неорганические кислоты и основания (H2S, HCN, H2CO3, NH4OH и др.), большинство органических кислот и некоторые соли [HgCl2, FeF3, Fe(CNS)3 и др.].
Поскольку степень диссоциации слабых электролитов мала, то справедливо отношение
α 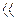 1, тогда уравнение (7.3) можно представить в виде:
1, тогда уравнение (7.3) можно представить в виде:
K = Cα2, (7.8)
откуда получим:
α = 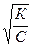 (7.9)
(7.9)
Классическая теория электролитической диссоциации позволила объяснить ряд опытных данных.
Так тепловой эффект реакций нейтрализации сильных кислот и оснований для всех кислот и оснований, отнесенный к одному грамм – молю воды, одинаков и равен тепловому эффекту реакции образования воды из ионов:
Н+ + ОН- = Н2О, (7.10)
что указывает на ионный характер реакции нейтрализации.
Электропроводность растворов электролитов увеличивается с разбавление раствора.
Это связано с тем, что при.разбавлении увеличивается степень диссоциации электролита, что, в свою очередь, приводит к увеличению числа ионов в растворе вследствие чего и возрастает электропроводность раствора.
 2015-05-26
2015-05-26 1083
1083







