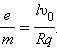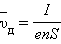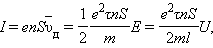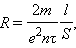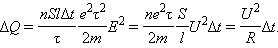Лекция. Электрический ток в различных средах
Электрический ток в металлах – это упорядоченное движение электронов под действием электрического поля. Опыты показывают, что при протекании тока по металлическому проводнику не происходит переноса вещества, следовательно, ионы металла не принимают участия в переносе электрического заряда.
Наиболее убедительное доказательство электронной природы тока в металлах было получено в опытах с инерцией электронов. Идея таких опытов и первые качественные результаты принадлежат русским физикам Л. И. Мандельштаму и Н. Д. Папалекси (1913 г.). В 1916 году американский физик Р. Толмен и шотландский физик Б. Стюарт усовершенствовали методику этих опытов и выполнили количественные измерения, неопровержимо доказавшие, что ток в металлических проводниках обусловлен движением электронов.
Схема опыта Толмена и Стюарта показана на рис. 3.3.1. Катушка с большим числом витков тонкой проволоки приводилась в быстрое вращение вокруг своей оси. Концы катушки с помощью гибких проводов были присоединены к чувствительному баллистическому гальванометру Г. Раскрученная катушка резко тормозилась, и в цепи возникал кратковременных ток, обусловленный инерцией носителей заряда. Полный заряд, протекающий по цепи, измерялся по отбросу стрелки гальванометра.
|
Рисунок 3.3.1. Схема опыта Толмена и Стюарта. 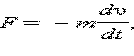
|
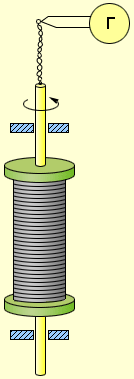
При торможении вращающейся катушки на каждый носитель заряда e действует тормозящая сила которая играет роль сторонней силы, то есть силы неэлектрического происхождения. Сторонняя сила, отнесенная к единице заряда, по определению является напряженностью E ст поля сторонних сил:
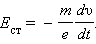
|
Следовательно, в цепи при торможении катушки возникает электродвижущая сила 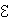 , равная
, равная
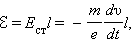
|
где l – длина проволоки катушки. За время торможения катушки по цепи протечет заряд q, равный
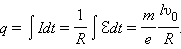
|
Здесь I – мгновенное значение силы тока в катушке, R – полное сопротивление цепи, υ0 – начальная линейная скорость проволоки.
Отсюда удельный заряд e / m свободных носителей тока в металлах равен:
|
Все величины, входящие в правую часть этого соотношения, можно измерить. На основании результатов опытов Толмена и Стюарта было установлено, что носители свободного заряда в металлах имеют отрицательный знак, а отношение заряда носителя к его массе близко к удельному заряду электрона, полученному из других опытов. Так было установлено, что носителями свободных зарядов в металлах являются электроны.
По современным данным модуль заряда электрона (элементарный заряд) равен
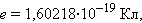
|
а его удельный заряд есть
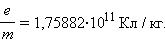
|
Хорошая электропроводность металлов объясняется высокой концентрацией свободных электронов, равной по порядку величины числу атомов в единице объема.
Предположение о том, что за электрический ток в металлах ответственны электроны, возникло значительно раньше опытов Толмена и Стюарта. Еще в 1900 году немецкий ученый П. Друде на основе гипотезы о существовании свободных электронов в металлах создал электронную теорию проводимости металлов. Эта теория получила развитие в работах голландского физика Х. Лоренца и носит название классической электронной теории. Согласно этой теории, электроны в металлах ведут себя как электронный газ, во многом похожий на идеальный газ. Электронный газ заполняет пространство между ионами, образующими кристаллическую решетку металла (рис. 3.3.1.1).
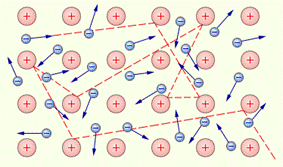
|
| Рисунок 3.3.1.1 Газ свободных электронов в кристаллической решетке металла. Показана траектория одного из электронов. |
Из-за взаимодействия с ионами электроны могут покинуть металл, лишь преодолев так называемый потенциальный барьер. Высота этого барьера называется работой выхода. При обычных (комнатных) температурах у электронов не хватает энергии для преодоления потенциального барьера.
Как ионы, образующие решетку, так и электроны участвуют в тепловом движении. Ионы совершают тепловые колебания вблизи положений равновесия – узлов кристаллической решетки. Свободные электроны движутся хаотично и при своем движении сталкиваются с ионами решетки. В результате таких столкновений устанавливается термодинамическое равновесие между электронным газом и решеткой. Согласно теории Друде–Лоренца, электроны обладают такой же средней энергией теплового движения, как и молекулы одноатомного идеального газа. Это позволяет оценить среднюю скорость 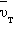 теплового движения электронов по формулам молекулярно-кинетической теории. При комнатной температуре она оказывается примерно равной 105 м/с.
теплового движения электронов по формулам молекулярно-кинетической теории. При комнатной температуре она оказывается примерно равной 105 м/с.
При наложении внешнего электрического поля в металлическом проводнике кроме теплового движения электронов возникает их упорядоченное движение (дрейф), то есть электрический ток. Среднюю скорость 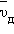 дрейфа можно оценить из следующих соображений. За интервал времени Δ t через поперечное сечение S проводника пройдут все электроны, находившиеся в объеме
дрейфа можно оценить из следующих соображений. За интервал времени Δ t через поперечное сечение S проводника пройдут все электроны, находившиеся в объеме 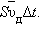
Число таких электронов равно 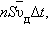 где n – средняя концентрация свободных электронов, примерно равная числу атомов в единице объема металлического проводника. Через сечение проводника за время Δ t пройдет заряд
где n – средняя концентрация свободных электронов, примерно равная числу атомов в единице объема металлического проводника. Через сечение проводника за время Δ t пройдет заряд 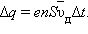 Отсюда следует:
Отсюда следует:
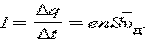
|
или
|
Концентрация n атомов в металлах находится в пределах 1028–1029 м–3.
Оценка по этой формуле для металлического проводника сечением 1 мм2, по которому течет ток 10 А, дает для средней скорости 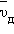 упорядоченного движения электронов значение в пределах 0,6–6 мм/c. Таким образом, средняя скорость
упорядоченного движения электронов значение в пределах 0,6–6 мм/c. Таким образом, средняя скорость 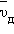 упорядоченного движения электронов в металлических проводниках на много порядков меньше средней скорости
упорядоченного движения электронов в металлических проводниках на много порядков меньше средней скорости 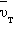 их теплового движения
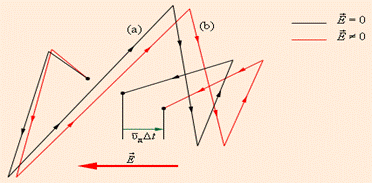
их теплового движения 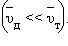 Рис. 3.3.1.2 дает представление о характере движения свободного электрона в кристаллической решетке.
Рис. 3.3.1.2 дает представление о характере движения свободного электрона в кристаллической решетке.
|
Рисунок 3.3.1.2.
Движение свободного электрона в кристаллической решетке: а – хаотическое движение электрона в кристаллической решетке металла; b – хаотическое движение с дрейфом, обусловленным электрическим полем. Масштабы дрейфа 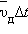 сильно преувеличены. сильно преувеличены.
|
Малая скорость дрейфа на противоречит опытному факту, что ток во всей цепи постоянного тока устанавливается практически мгновенно. Замыкание цепи вызывает распространение электрического поля со скоростью c = 3·108 м/с. Через время порядка l / с (l – длина цепи) вдоль цепи устанавливается стационарное распределение электрического поля и в ней начинается упорядоченное движение электронов.
В классической электронной теории металлов предполагается, что движение электронов подчиняется законам механики Ньютона. В этой теории пренебрегают взаимодействием электронов между собой, а их взаимодействие с положительными ионами сводят только к соударениям. Предполагается также, что при каждом соударении электрон передает решетке всю накопленную в электрическом поле энергию и поэтому после соударения он начинает движение с нулевой дрейфовой скоростью.
Несмотря на то, что все эти допущения являются весьма приближенными, классическая электронная теория качественно объясняет законы электрического тока в металлических проводниках.
Закон Ома. В промежутке между соударениями на электрон действует сила, равная по модулю eE, в результате чего он приобретает ускорение 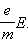 Поэтому к концу свободного пробега дрейфовая скорость электрона равна
Поэтому к концу свободного пробега дрейфовая скорость электрона равна
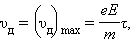
|
где τ – время свободного пробега, которое для упрощения расчетов предполагается одинаковым для всех электронов. Среднее значение скорости дрейфа 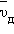 равно половине максимального значения:
равно половине максимального значения:
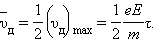
|
Рассмотрим проводник длины l и сечением S с концентрацией электронов n. Ток в проводнике может быть записан в виде:
|
где U = El – напряжение на концах проводника. Полученная формула выражает закон Ома для металлического проводника. Электрическое сопротивление проводника равно:
|
а удельное сопротивление ρ и удельная проводимость ν выражаются соотношениями:
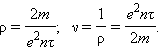
|
Закон Джоуля–Ленца. К концу свободного пробега электроны приобретают под действием поля кинетическую энергию
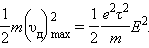
|
Согласно сделанным предположениям, вся эта энергия передается решетке при соударении и переходит в тепло.
За время Δ t каждый электрон испытывает Δ t / τ соударений. В проводнике сечением S и длины l имеется nSl электронов. Отсюда следует, что выделяемое в проводнике за время Δ t тепло равно:
|
Это соотношение выражает закон Джоуля–Ленца.
Таким образом, классическая электронная теория объясняет существование электрического сопротивления металлов, законы Ома и Джоуля–Ленца. Однако в ряде вопросов классическая электронная теория приводит к выводам, находящимся в противоречии с опытом.
Эта теория не может, например, объяснить, почему молярная теплоемкость металлов, также как и молярная теплоемкость диэлектрических кристаллов, равна 3 R, где R – универсальная газовая постоянная (закон Дюлонга и Пти, см. ч. I, § 3.10). Наличие свободных электронов на сказывается на величине теплоемкости металлов.
Электролитами принято называть проводящие среды, в которых протекание электрического тока сопровождается переносом вещества. Носителями свободных зарядов в электролитах являются положительно и отрицательно заряженные ионы. К электролитам относятся многие соединения металлов с металлоидами в расплавленном состоянии, а также некоторые твердые вещества. Однако основными представителями электролитов, широко используемыми в технике, являются водные растворы неорганических кислот, солей и оснований.
Прохождение электрического тока через электролит сопровождается выделением веществ на электродах. Это явление получило название электролиза.
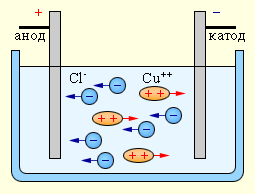
Электрический ток в электролитах представляет собой перемещение ионов обоих знаков в противоположных направлениях. Положительные ионы движутся к отрицательному электроду (катоду), отрицательные ионы – к положительному электроду (аноду). Ионы обоих знаков появляются в водных растворах солей, кислот и щелочей в результате расщепления части нейтральных молекул. Это явление называется электролитической диссоциацией. Например, хлорид меди CuCl2 диссоциирует в водном растворе на ионы меди и хлора:
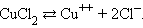
|
При подключении электродов к источнику тока ионы под действием электрического поля начинают упорядоченное движение: положительные ионы меди движутся к катоду, а отрицательно заряженные ионы хлора – к аноду (рис 1.15.1).
Достигнув катода, ионы меди нейтрализуются избыточными электронами катода и превращаются в нейтральные атомы, оседающие на катоде. Ионы хлора, достигнув анода, отдают но одному электрону. После этого нейтральные атомы хлора соединяются попарно и образуют молекулы хлора Cl2. Хлор выделяется на аноде в виде пузырьков.
Во многих случаях электролиз сопровождается вторичными реакциями продуктов разложения, выделяющихся на электродах, с материалом электродов или растворителей. Примером может служить электролиз водного раствора сульфата меди CuSO4 (медный купорос) в том случае, когда электроды, опущенные в электролит, изготовлены из меди.
Диссоциация молекул сульфата меди происходит по схеме
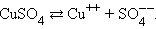
|
Нейтральные атомы меди отлагаются в виде твердого осадка на катоде. Таким путем можно получить химически чистую медь. Ион 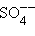 отдает аноду два электрона и превращается в нейтральный радикал SO4 вступает во вторичную реакцию с медным анодом:
отдает аноду два электрона и превращается в нейтральный радикал SO4 вступает во вторичную реакцию с медным анодом:
| SO4 + Cu = CuSO4. |
Образовавшаяся молекула сульфата меди переходит в раствор.
Таким образом, при прохождении электрического тока через водный раствор сульфата меди происходит растворение медного анода и отложение меди на катоде. Концентрация раствора сульфата меди при этом не изменяется.
|
| Рисунок 3.3.1.3 Электролиз водного раствора хлорида меди. |
Закон электролиза был экспериментально установлен английским физиком М. Фарадеем в 1833 году. Закон Фарадея определяет количества первичных продуктов, выделяющихся на электродах при электролизе:
Масса m вещества, выделившегося на электроде, прямо пропорциональна заряду Q, прошедшему через электролит:
|
Величину k называют электрохимическим эквивалентом.
Масса выделившегося на электроде вещества равна массе всех ионов, пришедших к электроду:
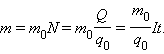
|
Здесь m 0 и q 0 – масса и заряд одного иона, 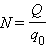 – число ионов, пришедших к электроду при прохождении через электролит заряда Q. Таким образом, электрохимический эквивалент k равен отношению массы m 0 иона данного вещества к его заряду q 0.
– число ионов, пришедших к электроду при прохождении через электролит заряда Q. Таким образом, электрохимический эквивалент k равен отношению массы m 0 иона данного вещества к его заряду q 0.
Так как заряд иона равен произведению валентности вещества n на элементарный заряд e (q 0 = ne), то выражение для электрохимического эквивалента k можно записать в виде
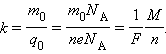
|
Здесь N A – постоянная Авогадро, M = m 0 N A – молярная масса вещества, F = eN A – постоянная Фарадея.
| F = eN A = 96485 Кл / моль. |
Постоянная Фарадея численно равна заряду, который необходимо пропустить через электролит для выделения на электроде одного моля одновалентного вещества.
Закон Фарадея для электролиза приобретает вид:
|
Явление электролиза широко применяется в современном промышленном производстве.
 2015-05-26
2015-05-26 5442
5442