Перед погружением в раствор сульфата меди медный электрод зачистите наждачной бумагой, погрузите на 2-3 с в концентрированную азотную кислоту, промойте водой, высушите и взвесьте с точностью до 0,01 г.
Подготовленный катод и медный анод опустите в электролизер проведите электролиз при определенной силе тока и в течении нескольких минут (точное время и заданную силу тока указывает преподаватель).
По окончании опыта катод промойте водой, высушите и взвесьте. По результатам взвешивания определите массу осажденной меди:
m = m2 – m1,
где:
m – масса осажденной меди, г;
m2 – масса катода после электролиза;
m1 – масса катода до электролиза.
Вычисление электрохимического эквивалента меди проведите на основе первого закона Фарадея:
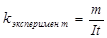
где:
k – электрохимический эквивалент;
I - сила тока, А;
t - продолжительность электролиза, с.
Определите ошибку опыта:
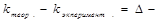 абсолютная ошибка опыта.
абсолютная ошибка опыта.
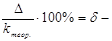 относительная ошибка опыта.
относительная ошибка опыта.
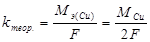
Полученные результаты занесите в таблицу:

 2015-05-26
2015-05-26 1171
1171








