Введение. Экология микроорганизмов является разделом общей микробиологии и изучает взаимоотношения микро- и макроорганизмов, совместно обитающих в определенных биотопах. В естественных средах обитания (почве, воде, воздухе, живых организмах) микробы входят в состав различных биоценозов. Экология микробов, вызывающих заболевания человека, определяется их способностью выживать во внешней среде, менять хозяев, сохраняться в организме хозяина на фоне действия иммунной системы, а также связана со способами их распространения, передачи и рядом других факторов. Оценка ряда экологических условий является одной из главных задач санитарной микробиологии.
Санитарно-бактериологические исследования лежат в основе практической работы санитарных врачей и эпидемиологов при санитарно-гигиенической оценке объектов окружающей среды, пищевых продуктов, напитков и т.д. и играют ведущую роль в профилактике инфекционных болезней. Важным объектом изучения медицинской микробиологии является нормальная микрофлора организма человека, которая включает микробы, обитающие на кожных покровах, слизистых оболочках различных органов (полости рта, зева, носоглотки, верхних участков дыхательных путей, кишечника, особенно толстой кишки, и т.д.). Одни из них являются постоянными (облигат-ными) обитателями организма человека, другие — временными (факультативными или транзиторными). Нормальная микрофлора — это жизненно важная система организма, которая обеспечивает защиту от многих патогенных микробов, созревание и стимуляцию иммунной системы, продукцию ряда витаминов и ферментов, участвующих в пищеварении, и др.
 Качественный и количественный состав микрофлоры человека меняется в течение жизни и зависит от пола, возраста, характера питания и др. Кроме того, колебания в составе микрофлоры человека могут быть обусловлены возникновением заболеваний и применением лекарственных препаратов, прежде всего антибиотиков и иммуномодуляторов. Оценка качественного и количественного состава микрофлоры организма человека по определенным показателям позволяет выявить его нарушение (дисбактериоз) и связанные с ним последствия.
Качественный и количественный состав микрофлоры человека меняется в течение жизни и зависит от пола, возраста, характера питания и др. Кроме того, колебания в составе микрофлоры человека могут быть обусловлены возникновением заболеваний и применением лекарственных препаратов, прежде всего антибиотиков и иммуномодуляторов. Оценка качественного и количественного состава микрофлоры организма человека по определенным показателям позволяет выявить его нарушение (дисбактериоз) и связанные с ним последствия.
Тема 8.1. МИКРОФЛОРА ВОДЫ, ВОЗДУХА И ПОЧВЫ. МЕТОДЫ САНИТАРНО-БАКТЕРИОЛОГИЧЕСКОГО ИССЛЕДОВАНИЯ ВОДЫ, ВОЗДУХА И ПОЧВЫ
▲ План
ж Программа
1. Микрофлора воды, воздуха и почвы.
2. Санитарно-показательные микроорганизмы и их значение.
3. Методы определения коли-индекса, коли-титра и микробного числа воды.
4. Методы определения микробного числа воздуха.
5. Методы определения перфрингенс-титра, коли-титра и микробного числа почвы.
А Демонстрация
1. Санитарно-бактериологическое исследование воды методом мембранных фильтров.
2. Санитарно-бактериологическое исследование воздуха. Аппарат Кротова. Рост микроорганизмов на МПА в чашке Петри. Рост гемолитических стрептококков на кровяном агаре.
3. Санитарно-бактериологическое исследование почвы. Рост Proteus vulgaris (по Шукевичу).
а Задание студентам
1. Провести оценку санитарно-бактериологического состояния воды по результатам определения микробного числа, коли-индекса и коли-титра.
2. Провести оценку санитарно-бактериологического состояния воздуха по результатам определения микробного числа.
3. Провести оценку санитарно-бактериологического состояния почвы по результатам определения микробного числа, коли-титра, перфрингенс-титра и титра термофильных бактерий.
4. Сделать посев смыва с кожи рук на глюкозопептон-ную среду.
• Микробиологические методы исследования окружающей среды
Для оценки санитарно-гигиенического состояния различных объектов окружающей среды, воды, пищевых продуктов и др. проводят санитарно-бактериологические исследования, целевое назначение которых состоит в определении эпидемической опасности. Однако прямое обнаружение патогенных микробов связано с рядом трудностей, обусловленных прежде всего низкой концентрацией данных микробов, которые, как правило, не могут размножаться в воздухе, воде, почве. Поэтому в санитарно-микробиологической практике применяют косвенные методы, основанные на определении общей микробной обсемененности того или другого объекта и на обнаружении в нем так называемых санитарно-показателъных бактерий (табл. 8.1.1).
Таблица 8.1.1. Санитарно-показательные бактерии окружающей среды и пищевых продуктов
| Объект | Характер загрязнения | Санитарно-показательные бактерии |
| Вода | Фекальное | Бактерии группы кишечных палочек Escherichia coli, Citrobacter freundii, Enterobacter aerogenes, Enterococ-cus faecalis |
| Почва | То же | Те же бактерии и клостридии {Clostridium perfringens, CI. sporo-genes и др.) |
| Промышленно-быто- | Термофильные бактерии, Proteus | |
| вые (разлагающиеся отбросы) | vulgaris | |
| Пищевые | Фекальное | Бактерии группы кишечных па- |
| продукты | лочек S. faecalis, P. vulgaris | |
| Орально-капельное | Staphylococcus aureus | |
| Предметы | Фекальное | Бактерии группы кишечных па- |
| обихода | лочек, P. vulgaris, E. faecalis | |
| Орально-капельное | S. aureus | |
| Воздух | То же | S. aureus, S. pyogenes |
| Вода, | Промышленное | Производственные штаммы мик- |
| почва, | робов | |
| воздух |
 О микробной обсемененности судят по микробному числу -общему количеству микробов, содержащихся в единице объема или массы исследуемого объекта (1 мл воды, 1 г почвы, 1 м3 воздуха). Содержание санитарно-показательных бактерий оценивают по двум показателям — титру и индексу. За титр принимают тот минимальный объем или массу исследуемого материала, в которых обнаруживают санитарно-показательные бактерии; индекс показывает количество санитарно-показательных бактерий, содержащихся в 1 л жидкости, 1 г плотных веществ, 1 м3 воздуха. К санитарно-показательным бактериям относятся представители облигатной микрофлоры организма человека и теплокровных животных, для которых средой обитания являются кишечник или респираторный тракт. Они обладают следующими свойствами: 1) постоянно выделяются в большом количестве из организма во внешнюю среду; 2) не имеют других мест обитания; 3) способны сохраняться в окружающей среде в течение тех же сроков, что и патогенные бактерии, паразитирующие в кишечнике или респираторном тракте; 4) не способны интенсивно размножаться на каких-либо объектах вне организма хозяина и изменять свои свойства. Перечисленные признаки присущи ряду бактерий, которые признаны санитарно-показательными для различных объектов окружающей среды (см. табл. 8.1.1).
О микробной обсемененности судят по микробному числу -общему количеству микробов, содержащихся в единице объема или массы исследуемого объекта (1 мл воды, 1 г почвы, 1 м3 воздуха). Содержание санитарно-показательных бактерий оценивают по двум показателям — титру и индексу. За титр принимают тот минимальный объем или массу исследуемого материала, в которых обнаруживают санитарно-показательные бактерии; индекс показывает количество санитарно-показательных бактерий, содержащихся в 1 л жидкости, 1 г плотных веществ, 1 м3 воздуха. К санитарно-показательным бактериям относятся представители облигатной микрофлоры организма человека и теплокровных животных, для которых средой обитания являются кишечник или респираторный тракт. Они обладают следующими свойствами: 1) постоянно выделяются в большом количестве из организма во внешнюю среду; 2) не имеют других мест обитания; 3) способны сохраняться в окружающей среде в течение тех же сроков, что и патогенные бактерии, паразитирующие в кишечнике или респираторном тракте; 4) не способны интенсивно размножаться на каких-либо объектах вне организма хозяина и изменять свои свойства. Перечисленные признаки присущи ряду бактерий, которые признаны санитарно-показательными для различных объектов окружающей среды (см. табл. 8.1.1).
Санитарно-показательными микробами, свидетельствующими о фекальном загрязнении окружающей среды, являются бактерии группы кишечной палочки (БГКП). Они принадлежат к разным родам семейства Enterobacteriaceae. Дифференциально-диагностические признаки БГКП представлены в табл. 8.1.2. Обнаружение E.coli в каких-либо объектах окружающей среды или пищевых продуктах считается наиболее достоверным показателем свежего фекального загрязнения. Наличие бактерий родов Citrobacter и Enterobacter указывает на относительно давнее фекальное загрязнение. Присутствие Clostridium perfrin-gens, С. sporogens и других клостридий в почве свидетельствует о ее фекальном загрязнении, причем как свежем, так и давнем, поскольку эти бактерии образуют споры, что позволяет им длительно сохраняться в окружающей среде (в частности, в почве). Обнаружение в объектах окружающей среды Enterococ-cusfaecalis также свидетельствует об их фекальном загрязнении. К группе термофильных бактерий относятся неродственные бактерии, представители различных семейств, способных размножаться при температуре 60 °С и выше {Lactobacillus lactis, Streptococcus thermophilus и др.). Они не являются постоянными обитателями кишечника человека и не служат критериями фекального загрязнения окружающей среды. Резкое увеличение количества этих бактерий может свидетельствовать о загрязнении почвы разлагающимися отбросами, поскольку они размножаются в саморазогревающемся навозе и компостах.
Таблица 8.1.2. Дифференциально-диагностические признаки БГКП
| Вид бактерий | Признак | |||||
| продукты сбраживания | метиловый красный | реакция Фо- геса— Проска- уэра | индоло- образо- вание | рост на цитрат- ной среде | рост в присутствии KCN |
Escherichia Смесь + — +
coli кислот
Citrobacter То же + — р + +
freundii
Enterobacter Бутан- — + — + +
aerogenes диол
Условные обозначения: (+) — положительная реакция, (—) — отрицательная реакция, р — различные реакции.
Бактерии, принадлежащие к роду Proteus {P.vulgaris и др.) семейства Enterobacterceae, широко распространены в природе. Эти гнилостные бактерии в большом количестве встречаются на разлагающихся останках животных и растений. Обнаружение этих бактерий в каких-либо пищевых продуктах свидетельствует о гнилостном распаде.
Гемолитические стрептококки (S.pyogenes), являясь транзитными обитателями носоглотки и зева, выделяются с капельками слизи воздушно-капельным путем. Сроки выживания гемолитических стрептококков в окружающей среде практически не отличаются от сроков, характерных для большинства других возбудителей воздушно-капельных инфекций. Обнаружение гемолитических стрептококков в воздухе помещений указывает на возможное его загрязнение микробами, содержащимися в зеве, носоглотке, верхних дыхательных путях человека и являющимися возбудителями воздушно-капельных инфекций. Staphylococcus aureus является факультативным обитателем носоглотки, зева, а также кожных покровов человека. Его присутствие в воздухе помещений или на находящихся там предметах является показателем воздушно-капельного загрязнения. Одновременное обнаружение золотистого стафилококка и гемолитических стрептококков свидетельствует о высокой степени загрязнения воздуха.
• Санитарно-бактериологическое исследование воды
Определение микробного числа воды. Водопроводную воду засевают в объеме 1 мл, воду открытых водоемов — в объемах 1,0; 0,1 и 0,01 мл. Все пробы вносят в стерильные чашки Петри, после чего их заливают 10—12 мл расплавленного и остуженного до 45—50 °С питательного агара, который тща-

 тельно перемешивают с водой. Посевы инкубируют при 37 °С в течение 1—2 сут. Воду из открытых водоемов засевают параллельно на две серии чашек, одну из которых инкубируют при 37 °С в течение 1 сут, а другую — 2 сут при 20 °С. Затем подсчитывают количество выросших на поверхности и в глубине среды колоний и вычисляют микробное число воды — количество микроорганизмов в 1 мл.
тельно перемешивают с водой. Посевы инкубируют при 37 °С в течение 1—2 сут. Воду из открытых водоемов засевают параллельно на две серии чашек, одну из которых инкубируют при 37 °С в течение 1 сут, а другую — 2 сут при 20 °С. Затем подсчитывают количество выросших на поверхности и в глубине среды колоний и вычисляют микробное число воды — количество микроорганизмов в 1 мл.
Определение коли-титра и коли-индекса воды. Коли-титр воды — минимальное количество воды (мл), в котором обнаруживаются БГКП. Коли-индекс — количество БГКП в 1 л воды. Эти показатели определяют титрационным (бродильным) методом или методом мембранных фильтров.
Метод титрования. Производят посев различных объемов воды в глюкозопептонную среду (1 % пептонная вода, 0,5 % раствор глюкозы, 0,5 % раствор хлорида натрия, индикатор Андреде и поплавок), причем для посевов больших количеств (100 и 10 мл) используют концентрированную среду, содержащую 10-кратные количества указанных веществ.
Воду открытых поверхностных водоемов исследуют в объемах 100; 10; 1,0 и 0,1 мл. Для исследования водопроводной воды делают посевы трех объемов по 100 мл, трех объемов по 10 мл и трех объемов по 1 мл. Посевы инкубируют в течение 1 сут при 37 °С. О брожении судят по наличию пузырьков газа в поплавке. Из забродивших или помутневших проб производят посевы на среду Эндо. Из выросших колоний делают мазки, окрашивают по методу Грама и ставят оксидазный тест, позволяющий дифференцировать бактерии родов Escherichia, Citrobacter и Enterobacter от грамотрицательных бактерий семейства Pseudomonadaceae и других оксидазоположительных бактерий, обитающих в воде. С этой целью стеклянной палочкой снимают 2—3 изолированные колонии с поверхности среды, наносят штрихом на фильтровальную бумагу, смоченную ди-метил-п-фенилендиамином. При отрицательном оксидазном тесте цвет бумаги не изменяется, при положительном она окрашивается в синий цвет в течение 1 мин. Грамотрицатель-ные палочки, не образующие оксидазу, вновь исследуют в бродильном тесте — вносят в полужидкий питательный агар с 0,5 % раствором глюкозы и инкубируют при 37 °С в течение 1 сут. При положительном результате определяют коли-титр и коли-индекс по статистической табл. 8.1.3.
Метод мембранных фильтров. Мембранный фильтр № 3 помещают в воронку Зейтца, вмонтированную в колбу Бунзена, которая присоединяется к вакуумному насосу. Мембранные фильтры предварительно стерилизуют кипячением в дистиллированной воде. Воду из водопроводной сети и воду артезианских скважин фильтруют в объеме 333 мл. Чистую воду открытого водоема фильтруют в объеме 100, 10, 1,0 и 0,1 мл, более загрязненную перед фильтрованием разводят стерильной
Таблица 8.1.3. Определение индекса бактерий группы кишечных палочек при исследовании воды
| Коли индекс |
| Количество положительных результатов |
| Пределы индекса |
Коли-титр
| нижний |
| верхний |
| из 3 объемов по 10 мл |
| из 3 объемов по 1 мл |
из 3 объемов по 100 мл
| Менее 3 | — | — | Более 3300 | |||
| 0,5 | ||||||
| 0,5 | ||||||
| 0,5 | ||||||
| 0,9 | ||||||
| Более! 100 | — | — | Менее 0,9 |
водой. Затем фильтры помещают на поверхность среды Эндо в чашки Петри и после инкубации при 37 °С в течение 1 сут подсчитывают количество выросших колоний, типичных для БГКП. Из 2—3 колоний красного цвета готовят мазки, окрашивают по методу Грама и определяют оксидазную активность. Для этого фильтр с выросшими на нем колониями бактерий переносят пинцетом, не переворачивая, на кружок фильтровальной бумаги, смоченной диметил-п-фенилендиамином. При наличии оксидазы индикатор окрашивает колонию в синий цвет. 2—3 колонии, не изменившие первоначальную окраску, засевают в полужидкую среду с 0,5 % раствором глюкозы. Посевы инкубируют в течение суток при 37 °С. При наличии газообразования подсчитывают число красных колоний на фильтре и определяют коли-индекс. Нормативные показатели для питьевой воды приведены в табл. 8.1.4.
Таблица 8.1.4. Нормативы для питьевой воды (ГОСТ 2874-82)
| Норматив |
Показатель
Число микробов в 1 мл воды, не более 100
Число бактерий группы кишечных палочек в 1 л воды 3
(коли-индекс), не более
Для определения титра Enterococcus faecalis готовят 10-кратные разведения воды. Цельную воду и ее разведения в объеме 1 мл засевают в одну из жидких элективных сред (КФ, поли-


 миксиновая и др.), инкубируют при 37 "С в течение 2 сут, через 24 и 48 ч производят высевы на плотные элективно-дифференциальные среды: агар КФ, агар ТТХ (среда с трифенилтетра-золий-хлоридом), полимиксинтеллуритный агар. Идентифицируют стрептококки по виду колоний, морфологии клеток и окраске по методу Грама. На среде с ТТХ стрептококки образуют колонии темно-красного цвета, на агаре с теллуритом — черного цвета.
миксиновая и др.), инкубируют при 37 "С в течение 2 сут, через 24 и 48 ч производят высевы на плотные элективно-дифференциальные среды: агар КФ, агар ТТХ (среда с трифенилтетра-золий-хлоридом), полимиксинтеллуритный агар. Идентифицируют стрептококки по виду колоний, морфологии клеток и окраске по методу Грама. На среде с ТТХ стрептококки образуют колонии темно-красного цвета, на агаре с теллуритом — черного цвета.
Состав сред. Среда КФ:2% питательного агара, 1 % дрожжевого экстракта, 2 % лактозы, 0,4 % азида натрия, 0,06 % карбоната натрия, индикатор бромкрезоловый красный.
Полимиксиновая среда: 2 % питательного агара, 1 % дрожжевого экстракта, 1 % глюкозы, полимиксин М 200 ЕД/мл, индикатор бромтимоловый синий.
Полимиксинтеллуритный агар: 2 % питательного агара, 1 % дрожжевого экстракта, 1 % глюкозы, кристаллический фиолетовый 1:800 000, полимиксин М 200 ЕД/мл, 0,01 % теллурита калия.
Агар трифенилтетразолий-хлорид (ТТХ): 2 % питательного агара, 1 % дрожжевого экстракта, 1 % глюкозы, кристаллический фиолетовый 1:800 000, 0,01 % ТТХ.
При определении индекса E.faecalis пользуются статистическими таблицами, применяемыми при установлении коли-ин-декса. Кроме того, с этой целью используют метод мембранных фильтров. Для обнаружения патогенных бактерий воду пропускают через мембранные фильтры, которые затем помещают в жидкие элективные среды или на поверхность плотных дифференциально-диагностических сред.
• Санитарно-бактериологическое исследование воздуха
Определение микробного числа воздуха. Количественные микробиологические методы исследования воздуха основаны на принципах осаждения (седиментации), аспирации или фильтрации.
Седиментационный метод. Две чашки Петри с питательным агаром оставляют открытыми в течение 60 мин, после чего посевы инкубируют в термостате при 37 "С. Результаты оценивают по суммарному числу колоний, выросших на обеих чашках: при наличии менее 250 колоний воздух считается чистым; 250—500 колоний свидетельствует о загрязнении средней степени, при количестве колоний более 500 — загрязненным.
Аспирационный метод. Это более точный количественный метод определения микробного числа воздуха. Посев воздуха осуществляют с помощью приборов. Аппарат Кротова (рис. 8.1.1) устроен таким образом, что воздух с заданной скоростью засасывается через узкую щель плексигласовой пластины, закрывающей чашку Петри с питательным агаром.

Рис.8.1.1. Аппарат Кротова для бактериологического исследования
воздуха.
При этом частицы аэрозоля с содержащимися на них микроорганизмами равномерно фиксируются на всей поверхности среды благодаря постоянному вращению чашки под входной щелью. После инкубации посева в термостате проводят расчет микробного числа по формуле:
а х 1000 х~ у
где а — количество выросших на чашке колоний; V — объем пропущенного через прибор воздуха, дм3; 1000 - стандартный объем воздуха, дм3.
При определении микробного числа воздуха используют питательный агар для выделения гемолитических стрептококков — кровяной агар с добавлением генцианового фиолетового с последующим контрольным микроскопированием и выборочным пересевом подозрительных колоний на кровяной агар.
Состав сред. Кровяной агар с генциановым фиолетовым: 2 % питательного агара, 5-10 % дефибринированной крови лошади, кролика или барана, генциановый фиолетовый (1:50 000).
Желточно-солевой агар (ЖСА): 2 % питательного ага-ра, 10 % хлорида натрия, 20 % (по объему) желточной взвеси (1 желток куриного яйца на 200 мл изотонического раствора хлорида натрия).
Для исследования воздуха могут применяться и другие приборы (Дьякова, Речменского, Киктенко, ПАБ-1 — пробоотбор-

 ник аэрозольный бактериологический, ПОВ-1 — прибор для отбора воздуха), с помощью которых определенный объем воздуха пропускают через жидкости или фильтры, а затем делают мерные посевы на питательные среды. Использование ПАБ-1 и ПОВ-1 позволяет исследовать большие объемы воздуха и обнаруживать патогенные бактерии и вирусы.
ник аэрозольный бактериологический, ПОВ-1 — прибор для отбора воздуха), с помощью которых определенный объем воздуха пропускают через жидкости или фильтры, а затем делают мерные посевы на питательные среды. Использование ПАБ-1 и ПОВ-1 позволяет исследовать большие объемы воздуха и обнаруживать патогенные бактерии и вирусы.
При исследовании воздуха стационаров (хирургических, аку-шерско-гинекологических и др.) осуществляют непосредственное выделение патогенных и условно-патогенных бактерий — возбудителей внутрибольничных инфекций (стафилококков, синегнойной палочки и др.). При возникновении внутрибольничных инфекций стафилококковой этиологии проводят исследования, направленные на выявление источников и путей распространения инфекций: путем фаготипирования определяют идентичность стафилококков, выделенных из объектов окружающей среды, а также от больных и обслуживающего персонала. Нормативные показатели микробного числа и содержания Staphylococcus aureus, разработанные для воздуха больничных помещений, приведены в табл. 8.1.5.
| S.aureus (в 250 л) |
| Микробное число |
Таблица 8.1.5. Критерии оценки микробного обсеменения воздуха в больничных помещениях
Место отбора проб
воды. Для определения перфрингенс-титра различные разведения почвенной суспензии по 1 мл засевают в пробирки со стерильным обезжиренным молоком или железосульфитной средой Вильсона—Блера, приготовленной ex tempore. Посевы инкубируют при 43 °С в течение 24—48 ч, после чего учитывают результаты по свертыванию молока или по образованию черных колоний Clostridium perfringens в агаровом столбике среды Вильсона—Блера. Из колоний делают мазки, окрашивают по Граму, микроскопируют и вычисляют перфрингенс-титр.
Состав сред. Среда Кесслера: 1 % пептона, 5 % желчи, 0,25 % лактозы, генциановый фиолетовый для подавления роста грамположительных бактерий.
Железосульфитная среда Вильсона —Блера: 3 % питательного агара, 1 % глюкозы, 2 % сульфита натрия, 0,08 % хлорида железа.
Для определения титра термофильных бактерий разведения почвенной суспензии по 1 мл вносят в чашки Петри, заливают расплавленным и охлажденным питательным агаром. Посевы инкубируют в течение суток при 60 °С, а затем подсчитывают количество выросших колоний и пересчитывают на 1 г почвы. Санитарно-микробиологическую оценку почвы производят по комплексу показателей, из которых наиболее важным является установление степени фекального загрязнения (табл. 8.1.6).
 Операционные
Операционные
до начала работы Не более 500 Не допускается
во время работы»» 1000 То же
Родильные комнаты»» 1000»»
Палаты для недоношенных детей»» 750»»
• Санитарно-бактериологическое исследование почвы
Определение микробного числа почвы. Почву берут на глубине 10—15 см стерильным ножом (из разных мест исследуемой территории не менее 10 проб) и помещают в стерильную банку. Из проб готовят навеску (30 г), которую вносят в колбу с водой (270 мл) и тщательно встряхивают. Из полученной суспензии готовят разведения 10~3, Ю-4, Ю-5. Из двух последних разведений берут по 0,1 мл и смешивают с 40 мл 0,7 % расплавленного и остуженного до 45 ' С питательного агара, после чего выливают вторым слоем в чашки Петри с 2 % питательным агаром. Посевы инкубируют при 37 °С, затем подсчитывают количество выросших колоний и определяют микробное число. Определение коли-титра, перфрингенс-титра и титра термофильных бактерий почвы. Различные разведения почвенной суспензии засевают по 1 мл в пробирки со средой Кесслера и инкубируют при 43 °С в течение 48 ч. В дальнейшем анализ проводят по схеме, применяемой при определении коли-титра
Таблица 8.1.6. Оценка санитарного состояния почвы по основным микробиологическим показателям
| Характеристика почвы | Коли-титр | Перфрингенс-титр | Количество термофильных бактерий в 1 г почвы |
Чистая 1,0 и выше 0,01 и выше 102—103
Загрязненная 0,9-0,01 0,009-0,0001 От 103 до 105
Сильно загрязнен- 0,009 и ниже 0,00009 и ниже От 105 до 4x106
ная
Тема 8.2. САНИТАРНО-БАКТЕРИОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕ ПРЕДМЕТОВ ОБИХОДА И ПИЩЕВЫХ ПРОДУКТОВ
▲ План
▲ Программа
1. Определение фекального загрязнения предметов обихода и рук персонала.
2. Санитарно-бактериологическое исследование молока и молочных продуктов.
3. Санитарно-бактериологическое исследование мяса, мясных продуктов и консервов.

 ▲ Задание студентам
▲ Задание студентам
1. Определить присутствие E.coli на коже рук и предметах обихода методом смывов; сделать заключение.
2. Провести санитарно-бактериологическую оценку молока, лимонада, мяса и мясных консервов.
3. Перечислить продукты, подлежащие контролю на ми-котоксины, антибиотики, консерванты, пестициды.
Определение фекального загрязнения предметов обихода (инвентарь, оборудование, мебель, посуда, игрушки и др.) и рук персонала. Стерильным ватным тампоном, увлажненным изотоническим раствором хлорида натрия, делают смыв с исследуемого предмета. Тампон помещают в среду Кесслера или втирают в поверхность среды Эндо. Посевы на плотных средах инкубируют при 37 "С, на жидких средах — при 43 "С.
Обсемененность предметов обихода золотистым стафилококком и фекальным стрептококком устанавливают аналогичным способом, используя для этого соответствующие питательные среды (см. методы исследования воды и воздуха).
Санитарно-бактериологическое исследование молока и молочных продуктов. О санитарно-бактериологическом состоянии молока и молочных продуктов судят по микробному числу и коли-титру. Для определения микробного числа пастеризованное молоко разводят стерильным изотоническим раствором хлорида натрия (1:10, 1:100, 1:1000) и по 1 мл каждого разведения выливают на дно стерильных чашек Петри, которые заливают расплавленным и остуженным агаром. Посевы инкубируют при 37 "С в течение 1 сут, после чего подсчитывают количество выросших колоний. Для определения коли-титра цельное пастеризованное молоко засевают в б пробирок со средой Кесслера: в 3 пробирки вносят по 1 мл молока, а в остальные 3 — по 0,1 мл молока (1 мл молока разводят в 10 раз стерильной водой). Посевы инкубируют при 43 "С в течение 1 сут, после чего из забродивших проб делают посевы на среду Эндо и инкубируют при 37 "С. Из выросших колоний красного цвета готовят мазки, окрашивают по методу Грама, микроскопируют и делают посев на среду Козера, а также в пептонную воду с 1 % глюкозы. Пробирки с посевами на среде Козера инкубируют при 37 "С, а на среде с глюкозой — при 43 °С в течение 1 сут. При оценке результатов учитывают бактерии, вызывающие брожение глюкозы с образованием кислоты и газа, но не дающие роста на цитратной среде
Козера.
Аналогичным образом исследуют сливки, молочнокислые продукты, мороженое. Определяют величину коли-титра и проводят оценку продукта в соответствии с нормативами (табл. 8.2.1; 8.2.2). Для обнаружения в молоке патогенных бактерий
делают посевы на соответствующие элективные и дифференциально-диагностические среды с последующим выделением чистых культур и их идентификацией.
Таблица 8.2.1. Определение коли-титра в молоке и других молочных продуктах (ГОСТ 9225-84)
| Кишечная палочк; | i обнаружена в следующих объемах, мл | Кол и-титр, мл | ||||
| 1,0 | 1,0 | 1,0 | 1,0 | 1,0 | 1,0 | |
| — | — | — | — | — | — | Более 3,0 |
| + | — | — | — | — | — | 3,0 |
| + | + | — | — | — | — | Менее 3,0 |
| + | + | + | — | — | — | Более 0,3 |
| + | + | + | + | — | — | 0,3 |
| + | + | + | + | + | — | Менее 0,3 |
| + | + | + | + | + | + | Более 0,03 |
Таблица 8.2.2. Санитарно-бактериологические нормативы для молока и молочных продуктов
| Продукт | Микробное | Коли- | Регламентирую- |
| число — допус- | титр | щий документ | |
| тимое количест- | не | ||
| во микробов в 1 мл или 1 г, не более | менее | ||
| Молоко пастеризованное в | |||
| бутылках и пакетах: | |||
| группа А | 5х104 | 3,0 | ГОСТ 13277-79 |
| группа Б | Ю5 | 0,3 | |
| Молоко во флягах и цис- | 2x105 | 0,3 | ГОСТ13277-79 |
| тернах | |||
| Сливки пастеризованные: | |||
| группа А | Ю5 | 3,0 | ОСТ 4964-74 |
| группа Б | 2х105 | 0,3 | |
| Кисломолочные продукты | Наличие толь- | 0,3 | ОСТ4929-84 |
| (кефир, простокваша, аци- | ко микрофло- | ||
| дофилин) | ры закваски | ||
| Молоко сгущенное с саха- | 105 | 0,1 | СТ1390-78 |
| ром | |||
| Кофе со сгущенным моло- | 3,5х104 | о,з | ГОСТ719-54 |
| ком и сахаром | |||
| Какао со сгущенным моло- | 3,5х104 | 0,3 | ГОСТ 718-54 |
| ком и сахаром | |||
| Мороженое | 105 | 0,3 | ОСТ 41156-80 |
| Детские молочные смеси | 5х102 | 11,1 | Инструкция |
| пастеризованные и вареные | ГСК 123-13, 132-1469 |
 Состав сред. Среда Козера: дистиллированная вода, 0,15 % фосфата натрия-аммония, 0,1 % фосфата калия одно-замещенного, 0,02 % сульфата магния, 0,25 % цитрата калия.
Состав сред. Среда Козера: дистиллированная вода, 0,15 % фосфата натрия-аммония, 0,1 % фосфата калия одно-замещенного, 0,02 % сульфата магния, 0,25 % цитрата калия.
Санитарно-бактериологическое исследование напитков (лимонад, минеральные воды). При исследовании лимонада и минеральных вод определяют микробное число и коли-титр, используя при этом методы, применяемые для исследования питьевой воды. Перед проведением исследования лимонад нейтрализуют 10 % раствором гидрокарбоната натрия, проверяя реакцию среды с помощью лакмусового индикатора. Отобранные пробы минеральной воды выдерживают при 43 "С в течение 1 ч для удаления избытка газа. Коли-титр определяют методом мембранных фильтров. С этой целью 500 мл напитка фильтруют через мембранные фильтры (100 мл через 1 фильтр), после чего последние промывают стерильной водой для удаления остатков минеральных солей и помещают на поверхность среды Эндо. Посевы инкубируют при 37 "С. После определения коли-индекса вычисляют коли-титр.
Санитарно-бактериологические нормативы для лимонада и минеральных вод соответствуют нормативам питьевой водопроводной воды. Такие же требования предъявляют к воде, используемой для приготовления кваса и различных фрукто-во-ягодных безалкогольных напитков.
Санитарно-бактериологическое исследование мяса, колбасных изделий и мясных продуктов. При микроскопическом исследовании мяса определяют количество бактерий в мазках-отпечатках, которые готовят из кусочков мяса размером 2x1,5x2,5 см. Мазки окрашивают по методу Грама и микроскопируют. Мясо считается свежим, если в поле зрения обнаружено не более 10 бактериальных клеток.
Бактериологическое исследование колбасных изделий и мясных продуктов проводят в соответствии с ГОСТом 9958-81: определяют микробное число, а также устанавливают присутствие БГКП, сальмонелл, бактерий рода Proteus, коагулазопо-ложительных стафилококков и клостридий. Анализ проводят не позднее чем через 4 ч с момента отбора проб, которые берут с поверхностных и глубинных участков продукта. При исследовании глубинных участков образцы продукта предварительно обрабатывают спиртом и обжигают. К навескам продукта массой 20 г добавляют 80 мл стерильного изотонического раствора хлорида натрия и гомогенизируют в электрическом смесителе. Для определения общего количества микробов в 1 г продукта делают посев 0,1 и 0,01 г продукта на питательный агар методом пластинчатых разводок Коха, инкубируют 48 ч и подсчитывают число колоний. Для определения БГКП в 1 г продукта производят посев 5 мл взвеси на среду КОДА, которая является элективно-дифференциальной средой для БГКП и содержит питательный бульон, сульфанол, лактозу и бромтимоловый
синий; инкубация продолжается 18—20 ч. При росте лактозо-положительных БГКП первоначальный синий цвет меняется на темно-зеленый или ярко-желтый. Специфические изменения на среде КОДА не требуют дальнейшего подтверждения. Определение сальмонелл проводят в навеске продукта не менее 25 г. Делают посев разведения навески в 100 мл среды обогащения (Мюллера, Кауфмана), инкубируют 24 ч. При наличии Proteus spp. наблюдается ползучий рост. В мазках выявляют грамотрицательные палочки, определяют их подвижность и идентифицируют культуру бактерий. Для определения коагула-зоположительных стафилококков проводят посев 0,2 мл взвеси продукта на желточно-солевой агар, инкубируют посевы при 37 °С и при комнатной температуре. При обнаружении стафилококков проводят их идентификацию (см. тему 12.1). Для обнаружения анаэробных спорообразующих бактерий Clostridium perfringens делают посев 10-кратных разведений взвеси в сульфитциклосериновую среду (СЦС) и среду Вильсона—Бле-ра. Посевы инкубируют при 46 "С в течение 12 ч; при наличии Cperfringens наблюдается почернение среды. При положительном результате посева разведения Ю-1 считается, что в 1 г продукта содержится 10 клеток соответствующих бактерий; разведения Ю-2 — 100 клеток и т.д.
Колбасные изделия и продукты из мяса в соответствии с действующими нормативами не должны содержать БГКП (в 1 г продукта), сальмонелл (в 25 г), бактерий рода Proteus и суль-фитредуцирующих клостридий (в 0,1 г); микробное число не должно превышать 103.
Санитарно-бактериологическое исследование консервов. При исследовании консервов определяют присутствие аэробных и анаэробных бактерий. По эпидемиологическим показаниям выявляют Clostridium botulinum и проводят исследование на наличие ботулинического токсина. Перед бактериологическим исследованием консервную банку проверяют на герметичность в сосуде с горячей водой, ставят контроль на бомбаж, выдерживая в термостате при 37 °С в течение 5 сут, после чего моют теплой водой, высушивают, протирают спиртом и обжигают верхнюю крышку смоченным спиртом горящим ватным тампоном. Извлеченное из банки содержимое засевают для выявления аэробной флоры в две пробирки с бульоном, а для обнаружения анаэробной микрофлоры — в две пробирки со средой Китта—Тароцци, содержащей 0,15 % агара. Посевы инкубируют при 37 °С в течение 5 сут. При появлении признаков роста аэробные бактерии пересевают на питательный агар, среду Эндо, скошенный агар (по Шукевичу) и на питательный агар с 1 % глюкозы. Из среды Китта—Тароцци берут 1—2 мл, вносят в чашки Петри и заливают расплавленным и охлажденным до 45—48 "С питательным агаром с 1 % глюкозы. После застывания на поверхность среды помещают стерильное пред-

 метное стекло (для создания анаэробных условий) и посевы инкубируют в течение 1 сут при 37 °С. Из выросших колоний получают чистую культуру, которую затем идентифицируют по обычной схеме.
метное стекло (для создания анаэробных условий) и посевы инкубируют в течение 1 сут при 37 °С. Из выросших колоний получают чистую культуру, которую затем идентифицируют по обычной схеме.
Для выявления ботулинического токсина исследуемые пробы консервов фильтруют и с фильтратом ставят реакцию нейтрализации токсина антитоксическими противоботулиничес-кими сыворотками типов А, В, С, Е, F на белых мышах или обнаруживают присутствие токсина с помощью других серологических реакций (иммуноферментный анализ). В консервах не допускается присутствия C.botulinum и его токсина, С.рег-fringens и других патогенных бактерий.
Присутствие аэробной неспорообразующей флоры указывает на недостаточную эффективность примененных методов консервирования и возможность порчи. Присутствие сапрофитных аэробных бацилл (B.subtilis, B.mesentericus) является допустимым при герметичности и отсутствии бомбажа консервных банок.
Кроме санитарно-бактериологических исследований, осуществляют контроль продуктов на присутствие других токсичных соединений: микотоксинов — зерновые культуры, кофе-бобы, сыры, овощи, фрукты; антибиотиков — мясо, птица, яйца, молоко; консервантов — молочные, мясные, овощные продукты, напитки; пестицидов — зерновые культуры, овощи, фрукты.
Тема 8.3. МИКРОФЛОРА ОРГАНИЗМА ЧЕЛОВЕКА
▲ План
▲ Программа
1. Особенности и основные понятия экологии микроорганизмов.
2. Качественные и количественные методы изучения состава микрофлоры отдельных биотопов.
3. Значение нормальной микрофлоры в жизни человека.
4. Микробиологическое исследование при дисбактерио-зе.
▲ Демонстрация
1. Окрашенные мазки, приготовление из чистых культур бактерий, представителей облигатной микрофлоры человека. Рост на скошенном агаре E.coli, Proteus vulgaris, Staphylococcus epidermidis.
2. Микрофлора зубного налета.
а Задание студентам
1. Приготовить мазки из зубного налета, микроскопиро-вать и зарисовать; сделать заключение.
2. Микроскопировать и зарисовать готовые мазки из чистых культур E.coli, C.perfhngens, грибов рода Candida.
3. По данным таблицы изучить качественный и количественный состав микрофлоры отдельных биотопов.
Для качественного изучения состава микрофлоры используют микроскопический и микробиологический методы исследования. Препараты (мазки) готовят из зубного налета, смывов со слизистой оболочки зева, окрашивают их по методу Грама и микроскопируют (рис. 8.3.1). Из зубного налета можно приготовить прижизненные препараты ("раздавленная" капля) и обнаружить подвижные микроорганизмы с помощью темнопольной или фазово-контрастной микроскопии. Для микробиологического исследования делают смывы с кожи лица, рук и других частей тела тампоном, смоченным в изотоническом растворе хлорида натрия. Затем этим же тампоном делают посев на питательные среды в чашках Петри. Кроме того, отдельный тампон помещают в пробирку с глюкозопептонной средой для обнаружения БГКП (состав среды см. тему 8.1).
Ориентировочно идентификацию микробов проводят по характеру выросших колоний, газообразованию на глюкозопептонной среде и морфологии клеток в мазках, окрашенных по методу Грама. Для количественных посевов берут определенный объем исследуемого материала (например, смывы из зева) или определенную навеску (например, фекалий), разводят в изотоническом растворе хлорида натрия (в зависимости от предполагаемой концентрации бактерий) и делают посевы соответствующих разведений на питательные среды: для выявления гемолитических стрептококков или стафилококка — на
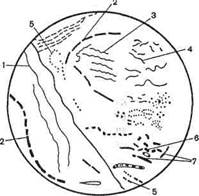 |
Рис.8.3.1. Микрофлора зубного налета.
1 — Leptotrichia spp. (L.buccalis) (Гр-удлиненные или нитевидные бактерии); 2 — Lactobacillus spp. (L.acido-philus, L.salivarius и др.) (Гр+ стреп-тобактерии); 3,4 — Treponema spp. (T.denticola, T.skoliodontum и др.) (Гр- нитевидные извитые бактерии); 5 — Streptococcus spp. (S.sali-varius, S.mitis, S.sanguis и др.) (Гр+ кокки); б - Vetlonella spp. (V.atipica и др.) (Гр- диплококки); 7 — Fuso-oacterium spp. (F.nucleatum и др.), Up-веретеновидные бактерии).
 кровяной агар, для выделения E.coli — на среду Эндо, для выделения дрожжеподобных грибов рода Candida — на среду Са-буро. Посевы производят таким образом, чтобы получить сосчитываемое количество колоний. Такие исследования повторяют через определенные сроки, чтобы сделать заключение о количественных изменениях состава микрофлоры в динамике заболевания (табл. 8.3.1).
кровяной агар, для выделения E.coli — на среду Эндо, для выделения дрожжеподобных грибов рода Candida — на среду Са-буро. Посевы производят таким образом, чтобы получить сосчитываемое количество колоний. Такие исследования повторяют через определенные сроки, чтобы сделать заключение о количественных изменениях состава микрофлоры в динамике заболевания (табл. 8.3.1).
Таблица 8.3.1. Состав нормальной, резидентной микрофлоры биотопов организма человека
| Микрофлора биотопа |
Ориентировочное содержание микробов
| В норме не содержат микробов и являются стерильными 102_ю4 на 1 см3 |
Кровь, лимфа, внутренние органы, головной и спинной мозг, спинномозговая жидкость
Кожа — сравнительно часто встречаются: Staphylococcus epidermidis S.saprophyticus (+) А Corynebacterium spp. (+) A Streptococcus spp. (+) A Bacillus spp. (+) A Candida spp. A Pseudomonas aeruginosa (—) A
| 108 в 1 мл слюны |
Полость рта — благоприятные условия для
разнообразной микрофлоры:
Streptococcus salivarius,
S. mitis, S. mutans, S.sanguis (+) A
Lactobacillus spp. (+) Ah
Bifidobacterium spp. (+) Ah
Leptotrichia buccalis (—)
Veilonella spp. (—) Ah
Bacteroides spp. (—) Ah
Candida spp. A
Treponema skoliodontum,
T.denticola (-) A
Neisseria spp. (-) A
Mycoplasma spp. A
Staphylococcus spp. (+) A
| Не более 103 в 1 мл содержимого |
Желудок — многие микроорганизмы погибают при кислом значении рН, встречаются:
Sarcina ventriculi (+) А
Lactobacillus spp. (+) А
Candida spp. A
| Около 105 в 1 мл содержимого |
Тонкая кишка — в верхних отделах кишки микрофлора представлена скудно в связи с активностью ферментов. Число микроорганизмов постепенно нарастает в илеоцекаль-ном отделе
Продолжение
| Микрофлора биотопа |
Ориентировочное содержание микробов
Толстая кишка — благоприятные условия для 1010 в 1 г фекалий
разнообразной микрофлоры, выделяются с
фекалиями:
Анаэробы (в совокупности)
Bacteroides spp. (—)
Bifidobacterium spp. (+)
Lactobacillus spp. (+)
Clostridium spp. (+)
Veilonella spp. (—)
Аэробы
E.coli и др. энтеробактерии (-)
Streptococcus faecalis (+)
Bacillus spp. (+)
Конъюнктива глаза — очень часто микроорганизмы полностью отсутствуют, могут встречаться:
Staphylococcus epidermidis (+) А
Corynebacterium spp. (+.) А
Уши (наружный слуховой проход) — факультативно встречаются:
Staphylococcus epidermidis (+) А
Corynebacterium spp. (+) А
Candida spp. A
Дыхательная система (верхние дыхательные пути)
Staphylococcus saprophytics (+) А
Streptococcus spp. (+) А
Klebsiella spp. (—) A
Neisseria catarralis (-) A
Candida spp. и др.
Мелкие бронхи, альвеолы и паренхима легких обычно не содержат микробов Мочеполовая система
| Число микробов в совокупности составляет 1010 в 1 мл влагалищного секрета. Соотношение анаэробов к аэробам 10:1 Стерильна |
Женские половые органы (влагалище и шейка матки)
| (+)Ah (+)A (+)Ah |
Lactobacillus spp. Corynebacterium spp. Peptococcus spp. и др.
Полость матки Мужские половые органы
| (+)A (ft-) A (+)A |
Mycobacterium smegmatis
Corynebacterium spp.
Staphylococcus epidermidis
 Продолжение
Продолжение
| Микрофлора биотопа |
Ориентировочное содержание микробов
Дистальная треть уретры (женщин и мужчин)
Peptostreptococcus spp. (+) Ан
Peptococcus spp. (+) Ан
Corynebacterium spp. (+) A
Mycoplasma hominis A
Staphylococcus epidermidis (+) A
Моча в почках, мочеточниках и мочевом пу- Стерильна зыре
При естественном мочеиспускании микробы Число микробов не попадают в мочу с наружного участка уретры должно превышать
103 КОЕ/мл
Микробиологическая диагностика дисбактериоза излагается в теме 13.2.
| Глава 9 |
ВЗАИМОДЕЙСТВИЕ ПАРАЗИТА И ХОЗЯИНА
В основе возникновения и развития инфекционного процесса лежит взаимодействие паразита и хозяина. Последнее включает ряд стадий, в которых микробы приобретают способность вызывать патологические процессы в организме человека. Патогенность (генетически детерминированная способность вызывать заболевания) является полидетерминантным признаком. Каждый патогенный микроорганизм несет генетическую информацию об образовании различных факторов вирулентности. К основным факторам вирулентности следует отнести экзо- и эндотоксины, некоторые ферменты и компоненты микробной клетки, например реснички, капсулу и др. Выявление факторов вирулентности является важным элементом при индикации и идентификации микроорганизмов.
Тема 9.1. ИНФЕКЦИЯ, ПАТОГЕННОСТЬ И ВИРУЛЕНТНОСТЬ МИКРОБОВ
▲ План
▲ Программа
1. Биологическое значение патогенности и вирулентности.
2. Методы экспериментального заражения и иммунизации животных.
3. Бактериологическое исследование трупов павших животных.
4. Методы изучения факторов вирулентности бактерий:
а) изучение взаимодействия лиганд-рецепторного ап
парата;
б) определение токсигенности микробов;
в) определение ферментов патогенности.
5. Особенности вирусных инфекций.
▲ Демонстрация
1. Капсула патогенных бактерий; окраска по методу Бурри—Гинса.
2. Корд-фактор Mycobacterium tuberculosis (метод Прайса); окраска по методу Циля—Нильсена.
▲ Задание студентам
1. Зарисовать демонстрируемые препараты: а) капсулу патогенных бактерий; б) корд-фактор М.tuberculosis.
2. Микроскопировать и зарисовать окрашенные метиле-новым синим мазки-отпечатки из органов белой мыши, павшей после заражения культурой патогенных бактерий. Определить присутствие бактерий во внутренних органах и тканях. Сделать заключение о форме инфекции и возможных причинах гибели животного.
3. Микроскопировать мазок со слизистой оболочки, окрашенный по методу Романовского—Гимзы. Найти и зарисовать "ключевые" клетки, покрытые адгезиро-ванными бактериями.
4. Микроскопировать и зарисовать мазок, демонстрирующий явление незавершенного фагоцитоза гонококков; окраска по методу Грама.
5. Учесть результаты опытов, поставленных с целью выявления факторов вирулентности стафилококков: гемолизина, лецитиназы, плазмокоагулазы.
6. Определить гемолитическую активность бактериального экзотоксина (О-стрептолизина).
Бактериоскопические методы выявления факторов вирулентности. Обнаружение капсулы у стрептококков (см. тему 2.2).
Выявление корд-фактора микобактерий. При выращивании микобактерий на предметных стеклах, погруженных в жидкую среду на основе цитратной крови, вирулентные штаммы вырастают в виде переплетающихся тяжей — корд-фактор. Для их обнаружения стекла окрашивают по методу Циля—Нильсена (см. рис. 14.3.2).
Выявление адгезии бактерий. При некоторых инфекциях бактерии в большом количестве прикрепляются к мем-
 бране эпителиальных клеток. Обнаружить это явление можно с помощью микроскопических методов в мазках со слизистой оболочки пораженного органа, окрашенных по методу Романовского—Гимзы. Такие клетки получили название ключевых.
бране эпителиальных клеток. Обнаружить это явление можно с помощью микроскопических методов в мазках со слизистой оболочки пораженного органа, окрашенных по методу Романовского—Гимзы. Такие клетки получили название ключевых.
Выявление незавершенного фагоцитоза (см. рис. 15.2.1). При микроскопии наблюдается большое количество неразрушенных микроорганизмов, расположенных внутри профессиональных фагоцитов.
Определение экзоферментов и экзотоксинов — факторов па-тогенности. Гиалуронидаза гидролизует гиалуроновую кислоту, которая перестает образовывать сгусток при добавлении уксусной кислоты. Для определения этого фермента в пробирку с субстратом (гиалуроновой кислотой) вносят суточную культуру бактерий или фильтрат бульонной культуры и инкубируют в течение 15 мин при 37 °С. Затем добавляют 2—3 капли концентрированной уксусной кислоты. В пробах, где содержится гиалуронидаза, не происходит образования сгустка.
Плазмокоагулаза выявляется при посеве испытуемой культуры в 0,4 мл стерильной цитратной плазмы крови. Посевы ингибируют при 37 "С в течение 2—5 ч. В случае выработки фермента происходит свертывание плазмы, а в контроле она остается жидкой.
Гемолизин определяют путем посева испытуемой культуры "бляшками" в чашки Петри с кровяным агаром. Чашки инкубируют в термостате при 37 °С в течение суток. В положительном случае вокруг "бляшек" образуются прозрачные зоны гемолиза.
Определение титра гемолитической активности бактериального экзотоксина (О-стрептолизина). Из фильтрата бульонной культуры р-гемолитического стрептококка готовят ряд двукратных серийных разведений. К каждому из них добавляют равный объем 5 % взвеси отмытых эритроцитов кролика. Смесь инкубируют в термостате при температуре 37 °С в течение 1 ч. Параллельно инкубируют контрольную взвесь эритроцитов в питательном бульоне того же состава. Учет результатов производят по наличию гемолиза (красная, прозрачная "лаковая" кровь) или отсутствию гемолиза (осадок эритроцитов). Определяют наибольшее разведение (титр) фильтрата бульонной культуры стрептококка, при котором еще наблюдается гемолиз. В дальнейшем этим разведением пользуются при определении рабочей дозы О-стрептолизина для постановки антистрептолизиновой реакции.
Лецитиназа выявляется при посеве на агар с лецитином. Вокруг колоний бактерий, выделяющих фермент, образуется зона помутнения с перламутровым блеском.
Лецитиназная проба: для быстрого обнаружения и серологической идентификации а-токсина клостридий — возбудителей газовой гангрены — в раневом отделяемом определяют
его лецитиназную активность в реакции нейтрализации с антисыворотками против токсинов клостридий разных видов (см. табл. 12.2.2). С этой целью исследуемый материал (раневое отделяемое) помещают в пробирки с раствором лецитина и добавляют антисыворотки. Присутствие лецитиназы в раневом отделяемом проявляется помутнением жидкости в пробирке. При нейтрализации лецитиназной активности токсина соответствующей антисывороткой жидкость остается прозрачной. Цитотоксины. Для обнаружения некоторых бактериальных токсинов, оказывающих цитопатическое действие на клетки (ЦПД), используют клеточные культуры. Бактерии выращивают в бульоне. Затем питательную среду отделяют от микробов и вносят в культуру чувствительных клеток. В положительном случае после инкубации наблюдается характерное ЦПД. Бактериальные токсины различаются по характеру ЦПД, которое может проявляться изменением формы, размеров клетки, появлением вакуолей в цитоплазме, нарушением целостности клеточного монослоя и т.д.
 2015-05-30
2015-05-30 4199
4199
