Неспорообразующие грамотрицательные анаэробы
Bacteroides fragilis
и другие виды рода Bacteroides
Prevotella melaninogenica
и другие виды рода Prevotella
Porphiromonas spp.
Fusobacterium spp.
Veilonella spp.
Неспорообразующие грамположительные анаэробы
Peptostreptococcus spp. Propionibacterium acnes
Спорообразующие грамположительные анаэробы
Clostridium perfringens Clostridium novyi Clostridium septicum Clostridium histolyticum Clostridium ramosum Clostridium sporogenes Clostridium tetani
Бактерии, перечисленные выше, вызывают гнойно-воспалительные процессы различной локализации, в том числе ангины, фурункулы, циститы и пиелиты, плевриты, перикардиты, сепсис и др. Многие из этих возбудителей встречаются в нормальной микрофлоре человека и проявляют свою патогенность только при нарушении нормальной экологии.
Стафилококки, стрептококки, протей, эшерихии и анаэробные бактерии нередко вызывают смешанную инфекцию как в разнообразных сочетаниях между собой, так и с другими микроорганизмами — вирусами, грибами.
Тема 12.1. АЭРОБНЫЕ БАКТЕРИИ -ВОЗБУДИТЕЛИ ГНОЙНО-ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ И РАНЕВЫХ ИНФЕКЦИЙ
▲ План
▲ Программа
1. Биологические свойства возбудителей гнойно-воспалительной и раневой инфекции, их патогенность, экология, особенности инфекции и эпидемиология вызываемых заболеваний.
2. Микробиологическая диагностика.
3. Диагностические препараты, профилактические и лечебные препараты.
А Демонстрация
1. Рост а- и р-гемолитических стрептококков на кровяном агаре.
2. Рост и образование пигмента P.aeruginosa на агаре.
3. Диагностические и лечебно-профилактические препараты.
ЗАНЯТИЕ 1
▲ Задание студентам
1. Микроскопировать и зарисовать мазки из чистых культур возбудителей гнойных инфекций: S.aureus, S.pyogenes, P.aeruginosa, E.coli, P.vulgaris. Окраска по методу Грама.
2. Микроскопировать и зарисовать мазки из гноя, содержащие возбудителей: стафилококков, стрептококков. Окраска по методу Грама.
3. Ознакомиться с питательными средами, применяемыми при микробиологической диагностике гнойных и раневых инфекций. Указать назначение отдельных питательных сред.
4. Микробиологическое исследование при раневых и гнойных инфекциях:
а) указать материал, подлежащий исследованию;
 |
 |
б) микроскопический метод: микроскопировать мазок
из гноя, окраска по методу Грама. Сделать вывод;
в) наметить план дальнейшего исследования.
ЗАНЯТИЕ 2
▲ Задание студентам
1. Микробиологическое исследование гноя:
а) учесть результат посева гноя на кровяной агар в
чашке Петри, описать подозрительные колонии,
отметить наличие гемолиза, составить план даль
нейшего исследования;
б) учесть результаты определения лецитиназы и плаз-
мокоагулазы у выделенной культуры стафилококка.
Сделать вывод;
в) учесть результаты определения чувствительности
культуры стафилококка к антибиотикам. Сделать
вывод.
2. Микробиологическое исследование мочи. Определить количество бактерий в 1 мл мочи по результатам метода секторных посевов. Дать заключение.
3. Серодиагностика ревматизма. Ознакомиться с описанием стрептолизиновой реакции. Внести в протокол результаты определения анти-О-стрептолизина в сыворотке крови больного. Сделать вывод.
4. Дать краткую характеристику демонстрируемым антимикробным, диагностическим и лечебно-профилактическим препаратам.
Материал для исследования: раневое отделяемое, гной, экссудат, моча, мазки со слизистых оболочек (носоглотки, зева и др.), кровь при подозрении на сепсис.
• Микробиологическая диагностика стафилококковых инфекций МЕТОДЫ ДИАГНОСТИКИ:
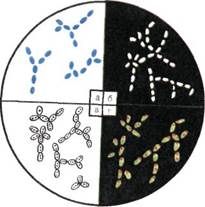
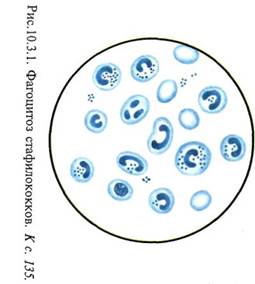
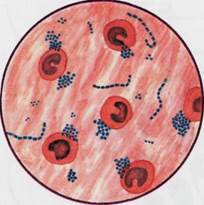
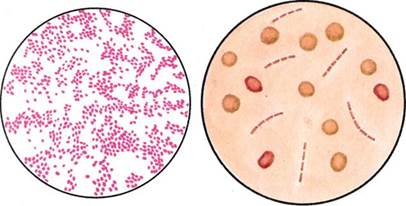
Бактериоскопическое исследование (схема 12.1.1). Из исследуемого материала (за исключением крови) готовят мазки для первичной бактериоскопии, окрашивают по методу Грама и микроскопируют. Наличие в препаратах грамположительных кокков, располагающихся в виде гроздевидных скоплений (рис. 12.1.1; на вклейке), позволяет поставить предварительный диагноз стафилококковой инфекции. Следует иметь в виду, что в патологическом материале стрептококки редко образуют типичные скопления, чаще располагаются поодиночке или небольшими группами по 2—3 бактерии.
Бактериологическое исследование. Испытуемый материал засевают петлей на чашки с кровяным и желточно-солевым агаром
Рис. 1.4. Культура дрожжей Sac--charomyces cerevisiae при разных методах микроскопии К с. 14. а — микроскопия мазка, окрашенного метиленовым синим; б - тем-нопольная микроскопия; в — фазо-во-контрастная микроскопия- г — люминесцентная микроскопия. Окраска корифосфином.
Рис.2.2.1. Смесь стафилококков и кишечных палочек. К с. 23. Окраска по методу Грама.
 |
 |
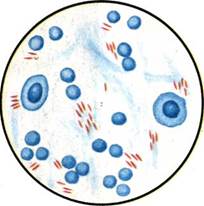 |
Рис.2.2.2. Возбудитель туберкулеза (Mycobacterium tuberculosis)
в мокроте. К с. 25. Окраска по методу Циля—Нильсена.
Рис.2.2.4. Возбудитель дифтерии (Corynebacterium diphtheriae). К с. 26.
Окраска по методу Нейссера. Видны зерна волютина.

 |
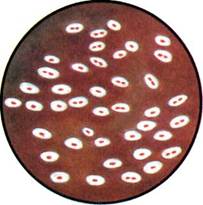 |
Рис.2.2.3. Споры и вегетативные
клетки возбудителя сибирской
язвы (Bacillus anthracis). К с. 25.
Окраска по методу Ожешко.
Рис.2.2.5. Капсула Klebsiellae pneumoniae. К с. 26. Окраска по методу Бурри—Гинса.
 |
 |
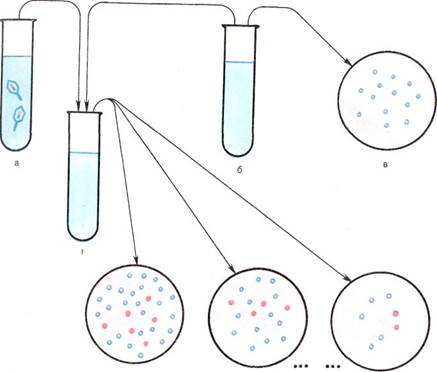 |
Рис.3.2.1. "Пестрый ряд". К с. 46.
а — ферментация углевода до кислоты и газа; б — отсутствие ферментации;
в — образование индола; г — образование сероводорода.
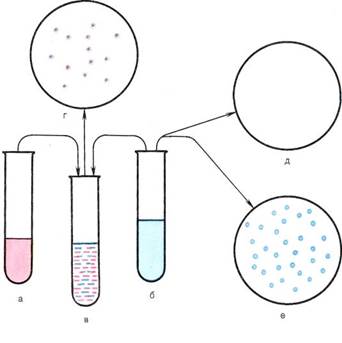
Рис.6.2. Постановка опыта специфической трансдукции (схема).Я' с. 26
пп™ЬГ i dga'; б ~ реципиент E-coli 1ас"; в - Рост колоний реципиентного „» р п Т^- ВДо; г *" ^Раженная транслирующим фагом X dgal культура b.coli lac; д - рост колоний трансдуктантов (красного цвета), несущих ген gal, на среде Эндо.
Рис.6.1. Постановка опыта трансформации. К с. 68. контаетСпе?™г5НК' в™еленно? из B.subtilis; б - реципиент B.subtilis; в -
селенной с^ЛЫХ ба,СГерИЙ С ДНК; Г ~ рост колоний Рекомбинантов на штамма н L?™ сойС1Рептоми«ином; д - отсутствие роста реципиентного 1мма на селективной среде со стрептомицином; е - рост колоний реципиентного штамма на среде без стрептомицина.
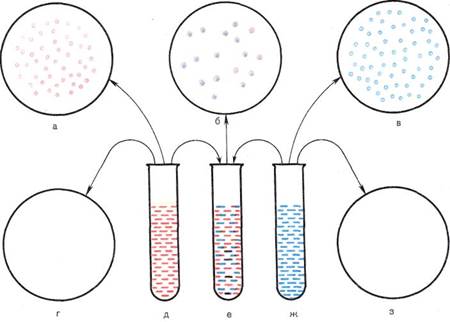 |
Рис.6.3. Постановка опыта по конъюгации. К с. 70. а — рост колоний бактерий донора на минимальной среде без стрептомицина; б — рост колоний рекомбинантов на селективной среде со стрептомицином без лейцина; в — рост колоний бактерий реципиентов на полной среде со стрептомицином и лейцином; г — отсутствие роста бактерий донора на среде со стрептомицином; д — донор-культура E.coli F, lei, su5; е — контакт между бактериями донора и реципиента; ж — реципиент-культура E.coli F", lei", st/; з — отсутствие роста бактерий реципиента на селективной среде со стрептомицином без лейцина.
 |
 |
 |
 |
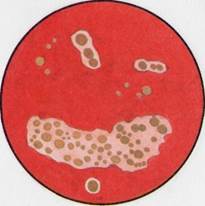 |
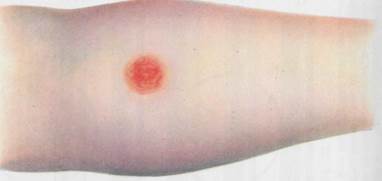
Рис. 10.4.1. Кожно-аллергическая проба. К с. 144.
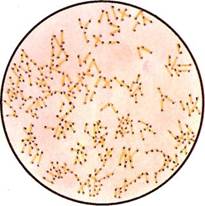
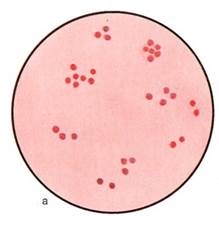
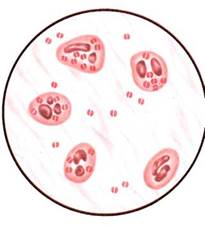
Рис. 12.1.2. Колонии стафилококка на кровяном агаре. А'с. 162.
 |
 |
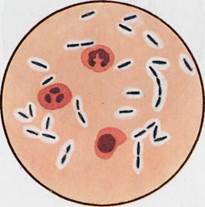 |
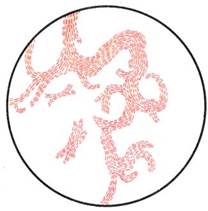
Рис. 12.1.1. Staphylococcus aureus и Streptococcus pyogenes в гное. Окраска по методу Грама. К с. 160.
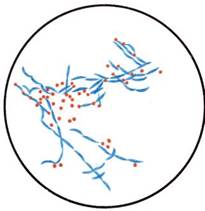
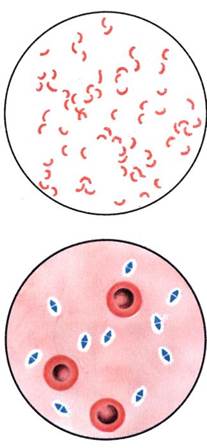
Рис. 12.2.1. Clostridium perfringens в отечной жидкости. К с. 174.

 |
 |
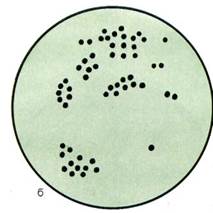 |
Рис. 13.2.1. Рост бактерий семейства Enterobacteriaceae на дифференциально-диагностических
средах. К с. 194. а — колонии Escherichia coli и Salmonella typhi на среде Эндо; б — колонии Salmonella typhi на висмут-сульфитном агаре.
Рис. 13.3.1. Vibrio cholerae. К с. 203 Окраска по методу Грама.
Рис. 14.1.1. Streptococcus pneumoniae в мокроте. К с. 214.

 |
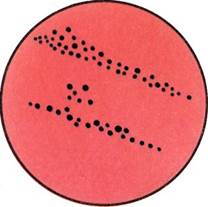 |
Рис. 14.2.1. Рост Corynebacteri-
um diphtheriae на кровяно-тел-
луритовой среде. К с. 231.
Рис. 14.3.2. Микрокультура Mycobacterium tuberculosis. К с. 240. Окраска по методу Циля — Нильсена.
 |
 |
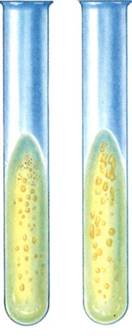 |
Рис. 14.3.1. Рост Mycobacterium
tuberculosis на среде Левенштей-
на — Йенсена. К с. 239.
Рис. 15.2.1. N. gonorrhoeae в гное
из мочеиспускательного канала.
К с. 253.
Окраска фуксином.

 |
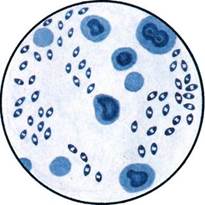 |
Рис. 16.1.1. Yersinia pestis в гное
из бубона. К с. 261.
Окраска метиленовым синим.
 Рис.16.1.3. Brucella melitensis (чистая культура). К с. 266.
Рис.16.1.3. Brucella melitensis (чистая культура). К с. 266.
Рис. 16.1.4. Bacillus anthracis (мазок из гноя). К с. 269.
 |
 |
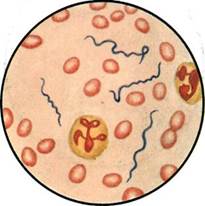 |
Рис. 16.1.2. Francisella tularensis
(чистая культура). К с. 263.
Окраска по методу Грама.
Рис. 17.1.1. Borrelia recurrentis в
крови больного. К с. 283.
Окраска по методу Романовского -
Гимзы.
 | ||
 |
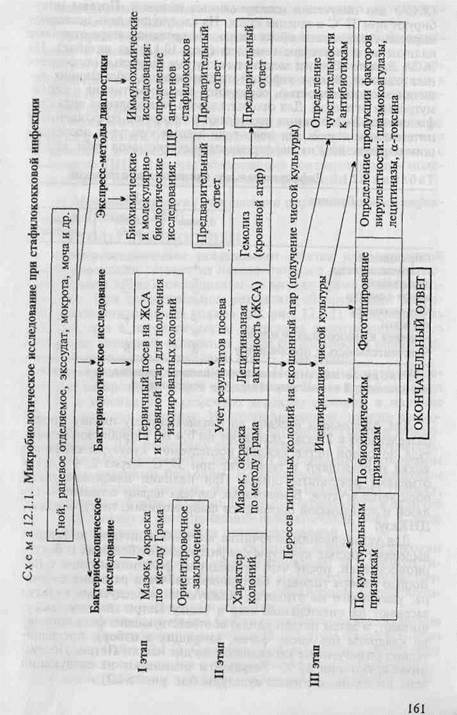 |
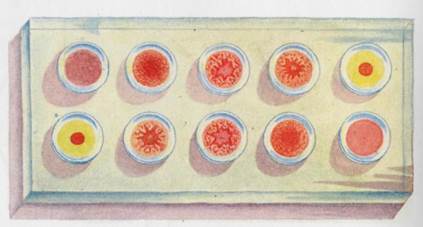
Рис. 18.1.1. Титрование вируса гриппа в РТГА с куриными эритроцитами. К с. 292. Объяснение в тексте.
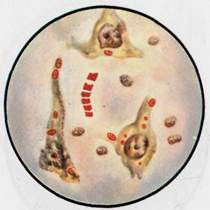 |
Рис.19.1.1. Тельца Бабеша —Нег-ри в нейронах гиппокампа. Срез головного мозга человека. К с. 305. Окраска по методу Романовского — Гимзы.
(ЖСА) для получения изолированных колоний. Посевы инкубируют при 37 °С в течение суток. На следующий день исследуют выросшие колонии на обеих средах. На кровяном агаре отмечают наличие или отсутствие гемолиза (рис. 12.1.2; на вклейке). На ЖСА S.aureus образует золотистые круглые выпуклые непрозрачные колонии. Вокруг колоний стафилококков, обладающих ле-цитиназной активностью, образуются зоны помутнения с перламутровым оттенком. Для окончательного установления вида стафилококка 2—3 колонии пересевают в пробирки со скошенным питательным агаром для получения чистых культур с последующим определением их дифференциальных признаков (табл. 12.1.1).
Таблица 12.1.1. Дифференциальные признаки стафилококков
| Вид |
| S.aureus |
| S.sapro-phyticus |
Признак
S.epider-midis
Образование:
плазмокоагулазы + — —
лецитиназы + — —
альфа-токсина + — —
Ферментация:
глюкозы + + —
маннита в анаэробных условиях + — +
Чувствительность к новобиоцину S S R
Условные обозначения:(+) — наличие признака; (—) — отсутствие признака; S — чувствительный; R — резистентный.
Для постановки реакции на плазмокоагулазу плазму крови, разведенную в 2 раза, разливают по 0,4 мл в пробирки, вносят туда по одной петле каждой исследуемой культуры стафилококка и помещают в термостат при 37 °С. Через 2, 4 и 24 ч отмечают результаты опыта. При наличии плазмокоагулазы образуется сгусток. В некоторых случаях наряду с плазмокоагу-лазой и лецитиназой определяют фибринолизин, гиалуронидазу, ДНКазу.
Для установления источника внутрибольничной инфекции выделяют чистые культуры стафилококка от больных и бактерионосителей, после чего проводят их фаготипирование с помощью набора типовых бактериофагов. Фаги разводят до титра, указанного на этикетке. Каждую из исследуемых культур засевают на питательный агар в чашку Петри газоном, высушивают, а затем петлей каплю соответствующего фага наносят на квадраты (по числу фагов, входящих в набор), предварительно размеченные карандашом на дне чашки Петри. Посевы инкубируют при 37 "С. Результаты оценивают на следующий день по наличию лизиса культуры (см. рис. 5.3.2).
Определение чувствительности стафилококка к антибиотикам — см. тему 7.2.
Экспресс-методы диагностики: иммунохимические, биохимические и молекулярно-биологические исследования.
Иммунохимические исследования. Основаны на обнаружении антигенов (токсинов и ферментов) возбудителя в материале от больного с помощью чувствительных серологических реакций.
Биохимические и молекулярно-биологические исследования. Исследуемый материал, полученный из очага инфекции, используют для обнаружения ДНК возбудителя с помощью ПЦР. В случае обнаружения соответствующих молекул можно поставить предварительный диагноз.
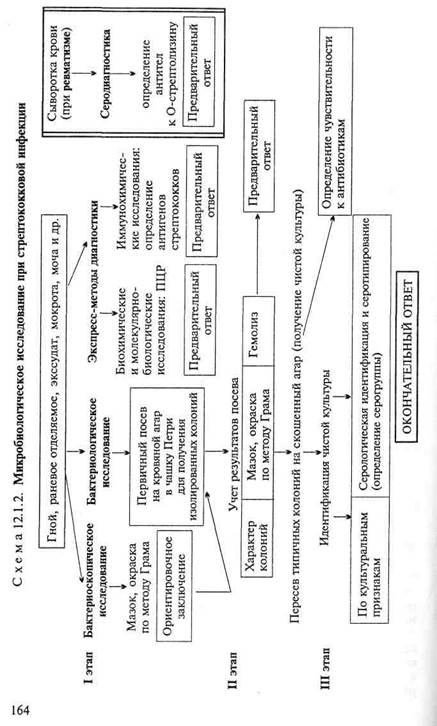
• Микробиологическая диагностика стрептококковых инфекций (схема 12.1.2)
МЕТОДЫ ДИАГНОСТИКИ:
Бактериоскопическое исследование. Мазки для первичной бактериоскопии готовят из патологического материала (за исключением крови), окрашивают по методу Грама и микроско-пируют. При положительном результате обнаруживают цепочки грамположительных кокков (см. рис. 12.1.1). Следует иметь в виду, что в патологическом материале стрептококки редко образуют типичные скопления, чаще располагаются поодиночке или небольшими группами по 2—3 бактерии.
Бактериологическое исследование. Исследуемый материал засевают на кровяной агар в чашку Петри. После инкубации при 37 "С в течение 24 ч отмечают характер колоний и наличие вокруг них зон гемолиза. Из части материала, взятого из колоний, готовят мазок, окрашивают по методу Грама и микро-скопируют. Для получения чистой культуры 1—3 подозрительные колонии пересевают в пробирки со скошенным кровяным агаром и сахарным бульоном. На кровяном агаре Streptococcus pyogenes образует мелкие, величиной с булавочную головку, мутноватые круглые колонии. В бульоне стрептококк в отличие от стафилококка дает придонно-пристеночный рост в виде хлопьев или зерен, оставляя среду прозрачной.
По характеру гемолиза на кровяном агаре стрептококки делятся на три группы: 1) негемолитические; 2) aj-гемолитические, или зеленящие, образующие зеленоватую зону частичного гемолиза; 3) р-гемолитические, образующие вокруг колонии полностью прозрачную зону гемолиза.
Заключительным этапом бактериологического исследования является идентификация выделенной культуры по антигенным свойствам (табл. 12.1.2). Серогруппу стрептококков определяют в реакции преципитации с экстрактом из исследуемой культуры (полисахаридным преципитиногеном С) и группоспецифи-

 |
ческими сыворотками (обычно 4 наиболее распространенные серогруппы — А, В, С и D). Развернутое серологическое исследование и типирование стрептококков проводят главным образом для эпидемиологического обследования.
Таблица 12.1.2. Дифференциальные признаки стрептококков
| Вид | Рост при | Рост на средах, содержащих | желчь (40%) | ||
| 10'С | 45 °С | метиленовый синий (0,1 %) | хлорид натрия (6,5 %) | ||
S.pyogenes — — — — —
S.pneumoniae — + ± — —
S.sanguis — ± — — +
S.salivarius — + — — —
| Вид | Рост при рН 9,6 | Термоустойчивость при 60 °С в течение 30 мин | Образование растворимого гемолизина | Антигенная группа (серо-группа) | |
| О | S | ||||
S.pyogenes — — + + А
S.pneumoniae — — + — —
S.sanguis ± H(—)
S.salivarius — — — — —(К)
Условные обозначения: (+) — наличие признака; (—) — отсутствие признака; (+) — наличие признака у одних штаммов и отсутствие его у других штаммов данного вида.
Экспресс-методы диагностики: иммунохимические, биохимические и молекулярно-биологические исследования.
Иммунохимические исследования. При отдельных нозологических формах стрептококковой инфекции устанавливают наличие специфических антигенов в крови больного с помощью РСК, реакции преципитации и др.
Биохимические и молекулярно-биологические исследования. Исследуемый материал, полученный из очага инфекции, используют для обнаружения ДНК возбудителя с помощью ПЦР. В случае обнаружения соответствующих молекул можно поставить предварительный диагноз.
Серодиагностика. Проводят при подозрении на ревматизм. Для подтверждения диагноза ревматизма определяют антитела к О-стрептолизину. Реакция основана на нейтрализации (подавлении) антителами, содержащимися в сыворотке крови больного, способности О-стрептолизина вызывать гемолиз. Реакцию ставят со стандартным сухим О-стрептолизином (табл. 12.1.3).
Для постановки реакции исследуемую сыворотку прогревают при 56 °С в течение 30 мин и разводят фосфатным буфером
 |
1:50, 1:250, 1:1000. Диагностический препарат О-стрептолизина также разводят буфером и применяют в количестве 0,3 мл, в котором содержится 1 рабочая доза О-стрептолизина. Рабочая доза — количество О-стрептолизина, которое почти полностью нейтрализуется половиной международной единицы анти-О-стрептолизина стандарта ГИСК. О-стрептолизин в рабочей дозе должен вызывать полный лизис 0,2 мл 5 % взвеси эритроцитов. Разведенную сыворотку и другие ингредиенты разливают по пробиркам так, как указано в табл. 12.1.3, и инкубируют. После инкубации отмечают последнюю пробирку, в которой сыворотка еще нейтрализует рабочую дозу О-стрептолизина (гемолиз отсутствует). Титр сыворотки выражают числом единиц анти-О-стрептолизина в 1 мл (АЕ St-О в 1 мл). В табл. 12.1.3 приведено число АЕ St-О в 1 мл сыворотки при нейтрализации О-стрептолизина различными разведениями сыворотки. Титр анти-О-стрептолизина до 250 АЕ St-О обнаруживается у практически здоровых людей. При ревматизме с первых дней болезни антитела к О-стрептолизину выявляются в высоких титрах — 500 АЕ St-О и выше.
• Микробиологическая диагностика гнойно-воспалительных заболеваний, вызванных грамотрицательными аэробными бактериями
МЕТОДЫ ДИАГНОСТИКИ:
Бактериоскопическое исследование. Из исследуемого материала (гной, раневое отделяемое, участки ожоговой ткани и др.) готовят мазки, окрашивают по методу Грама и микроско-пируют. Обнаружение в мазках грамотрицательных бактерий позволяет сделать предварительное заключение.
Бактериологическое исследование. Для выделения культуры Pseudomonas aeruginosa исследуемый материал засевают в чашки Петри на основные (МПА) или селективные питательные среды (агар, содержащий цитилпиридиний хлорид, который угнетает рост сопутствующей микрофлоры — ЦПХ-агар). Посевы инкубируют при 37 °С в течение суток. P.aeruginosa образуют круглые плоские слизистые колонии, окрашивая среду характерным сине-зеленым пигментом. При бактериоскопии темнопольным методом нативных препаратов, приготовленных из колоний, в "раздавленной" или "висячей" капле обнаруживают подвижные и слегка изогнутые палочки; в мазках, окрашенных по методу Грама, — грамотрицательные палочки. Чистые культуры P.aeruginosa идентифицируют по биохимическим признакам и образованию пигмента.
Для эпидемиологического анализа госпитальных инфекций определяют серовары в реакции агглютинации, пиоциновары и фаговары.
Для выделения энтеробактерий исследуемый материал засе-
вают на одну из дифференциально-диагностических сред, например на среду Эндо (см. тему 3.1). Для выделения бактерий рода Proteus используют метод Шукевича (см. тему 3.1).
Экспресс-методы диагностики: иммунохимические, биохимические и молекулярно-биологические исследования. Иммунохимические исследования. Патогенные штаммы P.aeruginosa выделяют различные растворимые белковые (экзотоксины и экзоферменты) и небелковые (экстрацеллюлярная слизь) антигены, которые могут быть обнаружены в материале от пациента (из очага, в крови или моче) с помощью чувствительных серологических реакций (ИФА и др.).
Биохимические и молекулярно-биологические исследования. Исследуемый материал, полученный из очага инфекции, используют для обнаружения ДНК возбудителя с помощью ПЦР. В случае обнаружения соответствующих молекул можно поставить предварительный диагноз.
• Микробиологическая диагностика сепсиса
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: кровь; при септико-пиемиях исследуют также материал из первичных и вторичных местных очагов инфекции. Кровь берут в период подъема температуры до начала антибиотикотерапии из локтевой вены в количестве не менее 10 мл у взрослых и 5 мл у детей, так как микроорганизмы находятся в крови в сравнительно небольших количествах. Посевы делают у постели больного в колбы с 50—100 мл питательной среды. Сравнительно большие объемы питательной среды (в 10 раз превышающие количество крови) необходимы для устранения бактерицидного действия сывороточных белков.
В случае необходимости транспортировки крови к ней добавляют антикоагулянты: цитрат или оксалат натрия, декстран сульфат, гепарин. В качестве добавки к среде для выделения бактерий из крови используют полианетолсульфонат натрия, являющийся антикоагулянтом и одновременно угнетающий бактерицидную активность сыворотки, фагоцитоз, инактиви-рующий комплемент и нейтрализующий лизоцим.
МЕТОДЫ ДИАГНОСТИКИ:
Бактериологическое исследование. Является ведущим при лабораторной диагностике сепсиса. Посевы производят на жидкие среды обогащения: сахарный бульон и др.; при подозрении на анаэробную флору — на тиогликолевую среду, среду Китта— Тароцци или другие элективные среды для анаэробов (см. тему 3.1) и инкубируют их при 37 °С в течение 10 дней при ежедневном контроле. В случае отсутствия роста микроорганизмов дают отрицательный ответ. При наличии роста делают мазки, которые окрашивают по методу Грама. Выделенную чистую
культуру микроорганизмов идентифицируют и определяют ее чувствительность к антибиотикам.
При оценке результатов необходимо исходить из того, что сепсис является тяжелым общим инфекционным заболеванием, развивающимся в условиях резкого угнетения всех основных механизмов иммунитета. Возбудителями сепсиса являются различные патогенные и условно-патогенные микроорганизмы. Однократный посев крови- при сепсисе не всегда приводит к выделению культуры. Более информативным является трехкратный посев крови с суточным интервалом. На фоне антибиотикотерапии кровь у больных для посева следует брать 5—6 раз.
• Микробиологическое исследование мочи
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: мочу собирают в объеме 3—5 мл при естественном мочеиспускании (средняя порция) или путем катетеризации. Микробиологическое исследование начинают не позднее Ь^2_3. после взятия мочи, так как находящиеся в ней микроорганизмы быстро размножаются при комнатной температуре; допускается хранение мочи в холодильнике не более 1 сут.
МЕТОДЫ ИССЛЕДОВАНИЯ:
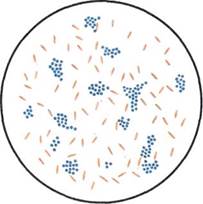
Бактериологическое исследование. Используют количественный метод секторных посевов, позволяющий определить степень бактериурии — число микробных клеток в 1 мл мочи. Посев мочи делают на чашку Петри с питательным агаром с помощью стандартной бактериологической петли. Вначале делают 30—40 штрихов в секторе А, затем прожигают петлю и делают 4 штриховых посева из сектора А в сектор I и таким же способом из I сектора во И, из II — в III сектор (рис. 12.1.3). Чашки инкубируют в течение суток при 37 °С, подсчитывают число выросших колоний и определяют степень бактериурии (табл. 12.1.4).
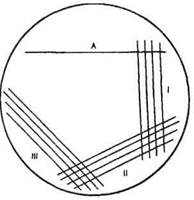 |
Рис.12.1.3. Секторные посевы для количественного определения бактерий в моче. Объяснение в тексте.
| Число колоний в секторах | Количество бактерий в 1 мл мочи | |||
| А | I | II | III | |
| Таблица 12.1.4. Определение степени бактериурии методом секторных посевов |
| 1—6 — — — Менее 103 |
 |
8-20 - - - З'Ю3
20-30 - - - 5-Ю3
30-60 - - - 104
70-80 - - - 5-Ю4
100-150 5-10 - - 105
Несосчитываемое 20—30 — — 5-Ю5
Несосчитываемое 40—60 — — 106
Несосчитываемое 100-140 10—20 - 5-Ю6
Несосчитываемое Несосчи- 30—40 — 107
тываемое
Несосчитываемое То же 60—80 Единичные 108
колонии
Степень бактериурии 105 микробных клеток и выше в 1 мл мочи указывает на воспалительный процесс. Показатель 103 микробных клеток в 1 мл мочи свидетельствует об отсутствии воспалительного процесса и обычно связан с контаминацией мочи. Степень бактериурии 104 расценивают как сомнительный результат, исследование необходимо повторить.
Параллельно с количественным учетом изучают выросшие колонии, выделяют и идентифицируют чистые культуры бактерий, определяют их чувствительность к антибиотикам. Количественное определение степени бактериурии имеет важное диагностическое значение и является одним из критериев эффективности антибактериальной терапии.
• Диагностические, профилактические и лечебные препараты
Стафилококковый анатоксин (очищенный и адсорбированный). Получают из нативного токсина путем его обезвреживания и осаждения трихлоруксусной кислотой с дополнительной очисткой этиловым спиртом и адсорбцией на гидрате оксида алюминия. Обладает высокими иммуногенными свойствами. Применяют для активной иммунизации с целью профилактики стафилококковых инфекций и для лечения стафилококковых заболеваний.
Стафилококковая вакцина. Взвесь коагулазоположительных золотистых стафилококков, инактивированных нагреванием. Применяют с целью лечения при длительно и вяло текущих стафилококковых заболеваниях. Чаще используют аутовакцину.
Иммуноглобулин человеческий противостафилококковый.
Гамма-глобулиновая фракция сыворотки крови, содержащая стафилококковый антитоксин. Готовят из крови животных или людей, иммунизированных стафилококковым адсорбированным анатоксином. Применяют для специфического лечения при стафилококковых заболеваниях.
Стафилококковый бактериофаг (жидкий). Фильтрат фаголи-зата стафилококков. Применяют наружно, внутрикожно, внутримышечно для лечения при стафилококковых заболеваниях.
Диагностические стафилококковые фаги. Набор типоспеци-фических фагов для фаготипирования стафилококков.
О-стрептолизин сухой. Лиофильно высушенный фильтрат бульонной культуры стрептококка — активного продуцента О-стрептолизина. Применяют для серодиагностики — определения антител к О-стрептолизину в сыворотках крови больных стрептококковыми инфекциями (чаще ревматизмом).
Антибиотики. Грамположительные бактерии — р-лак-тамные антибиотики, ванкомицин, тетрациклины, аминогли-козиды, макролиды, линкомицины, сульфаниламиды, фторхи-нолоны и др.
Грамотрицательные бактерии — р-лактамы, спектр действия которых сдвинут в сторону грамотрицательных микроорганизмов, хлорамфеникол, аминогликозиды, тетрациклины, сульфаниламиды, фторхинолоны и др.
Тема 12.2. АНАЭРОБНЫЕ БАКТЕРИИ - ВОЗБУДИТЕЛИ ГНОЙНО-ВОСПАЛИТЕЛЬНЫХ И РАНЕВЫХ ИНФЕКЦИЙ
▲ План
▲ Программа
1. Биологические свойства возбудителей анаэробных гнойно-воспалительных и раневых инфекций, их па-тогенность, экология, особенности инфекций и эпидемиология вызываемых заболеваний.
2. Микробиологическая диагностика гнойных заболеваний, вызванных неспорообразующими анаэробами.
3. Микробиологическая диагностика газовой гангрены.
4. Микробиологическая диагностика столбняка.
5. Биохимические и молекулярно-биологические методы диагностики анаэробной инфекции.
6. Диагностические, профилактические и лечебные препараты.
▲ Демонстрация
1. Мазки из чистых культур Clostridium perfringens, С. teta-ni, Bacteroides fragilis. Мазки из раневого отделяемого, содержащие смешанную микрофлору (клостридии, стафилококки, грамотрицательные бактерии и др.).
2.  Методика посева для выделения патогенных анаэробов.
Методика посева для выделения патогенных анаэробов.
3. Аппаратура и питательные среды для выращивания анаэробов.
4. Определение ct-токсина клостридий в раневом отделяемом с помощью летициназной пробы.
а Задания для выполнения лабораторной работы
1. Бактериоскопическое исследование: приготовить мазки из гноя, окрасить их по методу Грама и микроско-пировать. Сделать предварительное заключение и наметить ход дальнейшего исследования.
2. Сделать окончательное заключение о возбудителе или возбудителях раневой инфекции на основании бакте-риоскопических, бактериологических и других данных, полученных из бактериологической лаборатории.
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: гной, раневое отделяемое, кусочки мышечной ткани, перевязочный материал и др., кровь — при сепсисе. Для обеспечения бескислородных условий взятие материала производят шприцем с хорошо притертым поршнем до полного его заполнения и вытеснения воздуха. Затем шприц надевают на иглу, вставленную через резиновую пробку в пробирку со смесью инертных газов (N2 + Н2) и С02, и вводят в нее исследуемый материал, который изучают в микробиологической лаборатории. Используют также различные специальные транспортные среды, в которые помещают материал, взятый у больных.
• Микробиологическая диагностика гнойно-воспалительных заболеваний, вызванных неспорообразующими анаэробными бактериями
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: гной из очага, кровь — при сепсисе.
МЕТОДЫ ДИАГНОСТИКИ:
Бактериоскопическое исследование (см. схему 12.1.1). Из исследуемого материала (за исключением крови) готовят мазки для первичной бактериоскопии, окрашивают по методу Грама и микроскопируют. Наличие в препаратах бактерий позволяет поставить ориентировочный диагноз и наметить план дальнейшего исследования.
Бактериологическое исследование. Посевы производят на элективные обогатительные среды для анаэробов (среда Китта—Та-роцци, тиогликолевый бульон или полужидкий тиогликолевый агар), содержащие специальные добавки (гемин, витамин К и др.), и инкубируют при 37 °С в течение 24—48 ч. После просмотра выросшей культуры делают мазки, окрашивают их по методу Грама и микроскопируют. Бактериоскопия дает возможность установить однородность или неоднородность куль-
туры, а по морфологии клеток и тинкториальным свойствам ориентировочно отнести ее к определенному роду. Для получения чистой культуры делают пересевы на плотные среды в чашки Петри и инкубируют в анаэробных условиях 3—4 сут до формирования изолированных колоний. После изучения колоний их пересевают на элективные среды. Идентификацию выделенной чистой культуры производят на основании присущих ей дифференциальных признаков, которые определяют также в строго анаэробных условиях (табл. 12.2.1).
Таблица 12.2.1. Дифференциальные признаки неспорообразующих и спорообразующих анаэробных бактерий
| Признак | Бактерии | ||||||||
| Рер- | Рер- | Veil- | Вас- | C.per- | C.no- | C.se- | C.so- | C.hi- | |
| to- | tost- | lone l- | teroi- | frin- | vy | pti- | rdel- | stoty- | |
| сос- CUS | repto-сос-cus | la | des | gens | cum | li | ticum |

Условные обозначения: (+) — наличие признака; (—) — отсутствие признака; х — непостоянный признак; (+) — отсутствие признака у большинства штаммов; (±) — наличие признака у большинства штаммов; с — слабая ферментация.
 |
Экспресс-методы диагностики: иммунохимические, биохимические и молекулярно-биологические исследования. Биохимические и молекулярно-биологические исследования. Анаэробные бактерии вырабатывают специфические метаболиты, включая летучие жирные кислоты с короткой цепью, спирты и нелетучие органические кислоты. Для их обнаружения в материале от больного используют ГЖХ (см. главу 11).
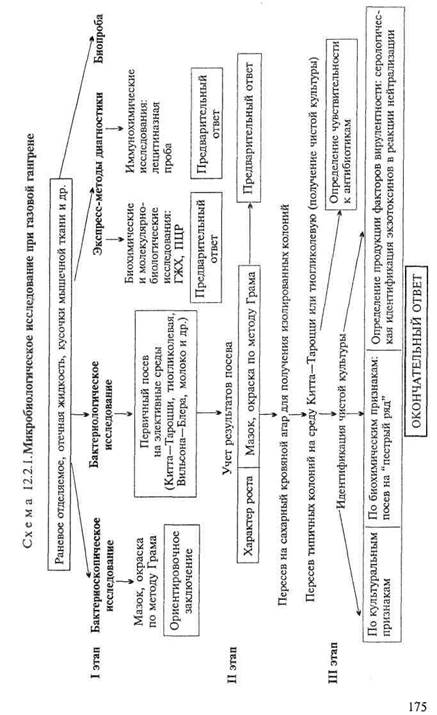
• Микробиологическая диагностика раневой анаэробной кло-стридиалъной инфекции — газовая гангрена (схема 12.2.1).
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: раневое отделяемое, отечная жидкость, кусочки мышечной ткани, перевязочный материал, кетгут. Рекомендуется брать материал из разных участков очага поражения, особенно из глубоких слоев. Кровь — при сепсисе.
МЕТОДЫ ДИАГНОСТИКИ:
Бактериоскопическое исследование. Проводят путем микроскопии мазков, приготовленных из отечной жидкости или некротизированной ткани. Наличие в препаратах крупных (1—1,5x3—10 мкм) грамположительных палочек, некоторые из которых (C.perfringens) образуют макрокапсулу (рис. 12.2.1; на вклейке), позволяет поставить предварительный диагноз.
Бактериологическое исследование. Исследуемый материал вносят в несколько пробирок со средой Китта—Тароцци, железо-сульфитным агаром (среда Вильсона—Блера) и молоком. Часть пробирок прогревают при 80 "С в течение 30 мин для уничтожения неспорообразующих бактерий. Посевы инкубируют в обычном термостате при 37 "С. C.perfringens растет в глубине среды. В молоке уже через 3—4 ч посева образуется губкооб-разный сгусток, содержащий пузырьки газа и отделившуюся прозрачную жидкость. Через сутки на среде Китта—Тароцци отмечается помутнение и газообразование, а на железосуль-фитном агаре несколько позднее появляются черные колонии в глубине агарового столбика. Для получения культур других видов клостридий требуются более строгие анаэробные условия. Из всех посевов делают мазки, окрашивают их по методу Грама и микроскопируют. При положительном результате обнаруживаются крупные грамположительные палочки.
Для получения чистой культуры делают пересевы на сахарный кровяной агар в чашки Петри и инкубируют в строго анаэробных условиях при 37 °С в течение 3—4 дней. Выросшие колонии пересевают в пробирки со средой Китта—Тароцци. Идентификацию чистой культуры производят на основании признаков, перечисленных в табл. 12.2.1. Идентификация по биохимическим признакам осуществляется традиционными методами или с помощью тест-систем для определения специфических бактериальных ферментов или метаболитов.


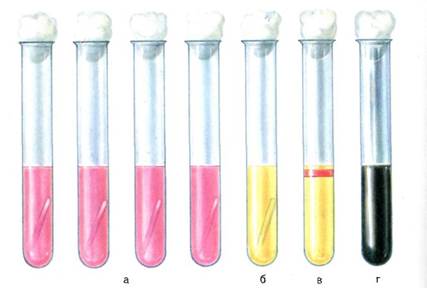
 Экспресс-методы диагностики: иммунохимические, биохимические и молекулярно-биологические исследования. Иммунохимические исследования. Лецитиназная проба: для быстрого обнаружения и серологической идентификации а-токсина клостридий в раневом отделяемом определяют его лецитиназ-ную активность в реакции нейтрализации (РН) с моновалентными антисыворотками против токсинов клостридий разных видов (табл. 12.2.2). С этой целью исследуемый материал (раневое отделяемое) помещают в пробирки с раствором лецитина и добавляют антисыворотки. Присутствие лецитиназы в раневом отделяемом выявляется помутнением жидкости в пробирке. При нейтрализации лецитиназной активности токсина соответствующей антисывороткой жидкость остается прозрачной.
Экспресс-методы диагностики: иммунохимические, биохимические и молекулярно-биологические исследования. Иммунохимические исследования. Лецитиназная проба: для быстрого обнаружения и серологической идентификации а-токсина клостридий в раневом отделяемом определяют его лецитиназ-ную активность в реакции нейтрализации (РН) с моновалентными антисыворотками против токсинов клостридий разных видов (табл. 12.2.2). С этой целью исследуемый материал (раневое отделяемое) помещают в пробирки с раствором лецитина и добавляют антисыворотки. Присутствие лецитиназы в раневом отделяемом выявляется помутнением жидкости в пробирке. При нейтрализации лецитиназной активности токсина соответствующей антисывороткой жидкость остается прозрачной.
Таблица 12.2.2. Постановка лецитиназной пробы для определения и идентификации токсинов клостридий в РН (форма протокола)
| Реагент | Количество реагента, мл | |||
| пробирка | пробирка | пробирка | пробирка | |
| Исследуемый материал 0,3 | 0,3 0,3 0,3 | |||
| Лецитин 0,1 | 0,1 0,1 - | |||
| Раствор хлорида натрия 0,1 | 0,2 | |||
| Сыворотка анти- C.perfringens — | 0,1 | |||
| Сыворотка анти- С. novy — | 0,1 | |||
| Инкубация при 37 "С в течение 46—60 мин | ||||
| Учет результатов (наличие | ||||
| помутнения) |
Примечание. При учете результатов используют обозначения: (+) — наличие помутнения; (—) — отсутствие помутнения.
Биохимические и молекулярно-биологические исследования. Исследуемый материал, полученный из очага инфекции, используют для обнаружения ДНК возбудителя с помощью ПЦР. В случае обнаружения соответствующих молекул можно поставить предварительный диагноз.
ГЖХ используют для обнаружения в материале от больного специфических метаболитов клостридий, включая летучие жирные кислоты с короткой цепью, спирты и нелетучие органические кислоты (см. главу 11).
Биопроба. Для серологической идентификации токсинов также можно использовать биопробу. Проводят РН токсина на лабораторных животных. С этой целью смесь исследуемого токсина с моновалентными антитоксическими сыворотками (к токсинам C.perfringens или других видов клостридий) вводят подкожно морской свинке. В случае нейтрализации токсина животное выживает; при отрицательной реакции морская свинка погибает через 30 мин — 4ч после инъекции.
• Микробиологическая диагностика столбняка (см. схему 12.2.1)
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: кусочки ткани вокруг предполагаемых входных ворот инфекции, перевязочный материал, кетгут. Рекомендуется брать материал из разных участков очага поражения, особенно из глубоких слоев. При подозрении на столбняк у женщин после родов или аборта — выделения из матки, у новорожденных — выделения из пупочной раны.
МЕТОДЫ ДИАГНОСТИКИ:
Бактериологическое исследование. Материал засевают в среду Китта—Тароцци и инкубируют в анаэробных условиях при 37 °С в течение 3—4 сут, наблюдая придонный рост бактерий. Затем делают посевы на сахарный агар в чашки Петри, в столбик сахарного питательного агара в пробирке. Посевы также инкубируют в анаэробных условиях. На поверхности кровяного агара C.tetani образует нежные прозрачные колонии, окруженные малозаметной зоной гемолиза. Для получения чистой культуры подозрительные колонии пересевают в пробирки со средой Китта—Тароцци и сохраняют их под слоем вазелинового масла или в эксикаторе, заполненном смесью инертных газов. Для определения способности выделенной чистой культуры к образованию столбнячного токсина (токси-генности) используют серологические реакции (преципитации в геле и др.) с антителами к тетаноспазмину. Бактериологический метод используют в качестве дополнительного метода для подтверждения диагноза, поскольку он не дает своевременного результата.
Экспресс-методы диагностики: иммунохимические, биохимические и молекулярно-биологические исследования. Иммунохимические исследования. Токсин в материале может быть обнаружен с помощью серологических реакций in vitro (ИФА и др.). Метод позволяет получить ответ в течение нескольких часов и обеспечивает своевременную диагностику заболевания.
Биопроба. Проводят для обнаружения столбнячного токсина в исследуемом материале. С этой целью материал растирают в стерильной ступке с песком, заливают изотоническим раствором хлорида натрия для экстрагирования токсина и фильтруют через бумажный фильтр. Фильтрат вводят внутримышечно белым мышам. Животным контрольной группы вводят смесь фильтрата с антитоксической сывороткой. Через 1—2 сут у мышей появляется ригидность мышц хвоста и задних конечностей. В результате резкого сокращения хвостовых мышц хвост поднимается в виде дуги. Затем подопытные животные погибают. У животных в контрольной группе признаки инток-

| Эшерихиоз Шигеллез (бактериальная дизентерия) |
| » |
сикации отсутствуют вследствие нейтрализации токсина антисывороткой. В настоящее время биопроба практически не применяется.
• Диагностические, профилактические и лечебные препараты
Антитоксические противогангренозные сыворотки — моновалентные (антиперфрингенс, антиэдематиенс — антинови, анти-септикум и др.) и поливалентная. Сыворотки получают путем иммунизации лошадей соответствующими анатоксинами, с последующей очисткой и концентрацией методом ферментативного гидролиза (диаферм-3). Препараты выпускаются в жидком и сухом виде. Применяют для экстренной пассивной профилактики и специфической иммунотерапии газовой гангрены.
Адсорбированный столбнячный анатоксин. Получен путем обезвреживания формалином столбнячного токсина с последующей его очисткой, концентрацией и адсорбцией на гидрате оксида алюминия. Входит в состав ассоциированной коклюш-но-дифтерийно-столбнячной вакцины и других препаратов. Применяют для активной иммунизации против столбняка.
Противостолбнячная сыворотка. Получена из крови лошадей, гипериммунизированных столбнячным анатоксином. Очищена и концентрирована методом диаферм-3. Активность измеряется в международных единицах. Применяют для экстренной пассивной профилактики и лечения столбняка.
Иммуноглобулин человеческий противостолбнячный. Получен из гамма-глобулиновой фракции крови доноров, ревакциниро-ванных очищенным адсорбированным столбнячным анатоксином. Применяют для экстренной пассивной профилактики и лечения столбняка.
Антибиотики. Грамположительные бактерии — р-лактамные антибиотики, ванкомицин, тетрациклины, макро-лиды, линкомицины, метронидазол.
Грамотрицательные бактерии — р-лактамы, спектр действия которых сдвинут в сторону грамотрицательных микроорганизмов, хлорамфеникол, тетрациклины, сульфаниламиды, метронидазол.
Аминогликозиды и фторхинолоны, как правило, не активны по отношению к анаэробным микробам.
| Глава 13 |
 2015-05-30
2015-05-30 6143
6143
