Под химическим источником электрической энергии, или гальваническим элементом, понимают электрохимическую систему, состоящую из двух различных электродов, помещенных в электролит.
Пример: элемент Якоби (рис.1.9). На электродах протекают полуреакции (электродные процессы):
на Zn-электроде Zn-2e = Zn2+
на Сu-электроде Cu2+ + 2e = Cu.
Появление ЭДС осуществляется за счет химической реакции вытеснения:
Zn + CuSО4= Сu + ZnSО4
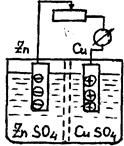
Рис.1.9. Принципиальное устройство химического источника тока
При большом R ток в цепи приближается к нулю, а Е - к Еравн. Гальванический элемент выделяет электрическую энергию во внешнюю цепь за счет химической реакции.
Изображают гальванический элемент согласно ЮПАК:
(-)Me|Zn|ZnSО4,H2О||CuSО4,H2О|Cu|Me(+)
Если в цепь рис.1.9 установить внешний источник тока обратного направления, то на электродах элемента Якоби-Даниэля пойдут те же реакции, но в обратном направлении:
на Zn-электроде: Zn2++2e=Zn,
на Сu- электроде: Сu - 2е = Сu2+.
Токообразующая реакция остается прежней, но сменит направление:
|
|
|
Сu + ZnSО4 = CuSО4 + Zn.
Такой гальванический элемент называют обратимым.
Если при пропускании тока в различных направлениях на электродах протекают различные электродные процессы, такой гальванический элемент является необратимым (его не восстановить как аккумуляторы подзарядкой).
Пример. Вольтов столб Zn|H2SО4|Cu
Реакции на электродах:
прямая обратная
на Zn: Zn-2e = Zn2+ 2Н+ + 2е = Н2
на Сu: 2Н+ + 2е = Н2 Сu - 2е = Сu2+
Zn+H2SО4=ZnSО4+H2 Cu+H2SО4=CuSО4+H2
Задача электрохимии - установить электродные процессы, токообразующую реакцию, ее обратимость. Помогает термодинамика, устанавливающая связь величины ЭДС с изменением энергии Гиббса токообразующей реакции.
 2015-05-22
2015-05-22 560
560








