Определить константу нестойкости комплексных соединений по величинам условных стандартных потенциалов (Е*) и значениям Ео систем Ag+/Ag = 0,799 В (I гp.), Сu2+/Сu=0,337В (П гр.), Biз+/Bi= 0,215 В (Ш гр.) - табл.1.3.
Таблица 1.3
| Вариант | Е*,В | Вариант | Е*,В | Вариант | Е*,В |
| 0,150 | -0,35 | -0,85 | |||
| 0,100 | -0,40 | -0,90 | |||
| 0,050 | -0,45 | -0,95 | |||
| 0,000 | -0,50 | -1,00 | |||
| -0,050 | -0,55 | -1,05 | |||
| -0,100 | -0,60 | -1,10 | |||
| -0,150 | -0,65 | -1,15 | |||
| -0,200 | -0,70 | -1,20 | |||
| -0,250 | -0,75 | -1,25 | |||
| -0,300 | -0,80 | -1,30 |
1.11.4. Расчет величин равновесных потенциалов в водных растворах
При использовании величин условных стандартных потенциалов Е* величина равновесного потенциала Е рассчитывается непосредственно по величине концентрации потенциалопределяющего вещества С, выраженной в молях в литре:
E=E*+ 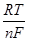 lnC. (1.2)
lnC. (1.2)
Необходимо учитывать также температурную зависимость величин Е*. Пример
Рассчитать равновесный потенциал цинка при 40°С, концентрации в растворе ZnSО4, равной 60 г/л.
В справочнике по электрохимии не выделены отдельной строкой сульфатные системы, что говорит об отсутствии в них заметного комплесообразования и позволяет в расчетах по уравнению (1.2) использовать вместо величин Е* величины Е°.
Е°298 =-0,7629 В; dE°/dT= 0,091 mB К-1, отсюда E°313 = Е°298+ +0,091×10-3× (Т-298) = -0,7629 +0,0012 = -0,7617 В,
С = 60/МZnSO  = 60/161,4 = 0,372 моль× л-1.
= 60/161,4 = 0,372 моль× л-1.
Подставляем в уравнение (1.2) соответствующие величины:
Е = Е° + 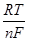 ×ln C= -0,7617 + [(8,314× 313)/(2× 96484)]×ln0,372=-0,7761 В.
×ln C= -0,7617 + [(8,314× 313)/(2× 96484)]×ln0,372=-0,7761 В.
 2015-05-22
2015-05-22 575
575








