Полиэлектролиты – это ВМС, которые содержат в своём составе группы, способные к ионизации. Белки являются наиболее распространёнными полиэлектролитами. Макромолекулы белков формируются из аминокислот. При взаимодействии карбоксильных и аминогрупп образуются пептидные связи, которые формируют полипептидные цепи белков:
В макромолекулах белков возможно различное сочетание полипептидных цепей, формирующихся всего из 20 простых аминокислот. Полипептидные цепи образуют первичную структуру белковой молекулы, под которой подразумевается ковалентная структурная основа и определённая последовательность остатков аминокислот.
Различают фибриллярную и глобулярную структуру белковой молекулы. Фибриллярные белки обычно нерастворимы в воде. В их структуре макромолекулы навиты друг на друга, как канат. Например, это кератин волос, миозин мышц, коллаген и желатин. Глобулярные белки имеют специфически свёрнутую форму макромолекул и способны к образованию глобул. Они имеют хорошую растворимость в воде и реакционную способность. Примеры – альбумины и глобулины яичного белка, молока, сыворотка крови, пепсин желудочного сока.
|
|
|
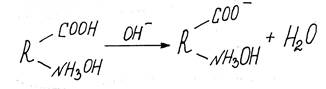 |
В щелочной среде молекулы белка диссоциируют как кислота и заряжаются отрицательно:
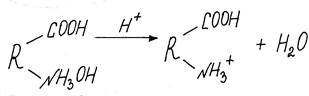 |
В кислой среде белок диссоциирует как основание, заряжаясь положительно:
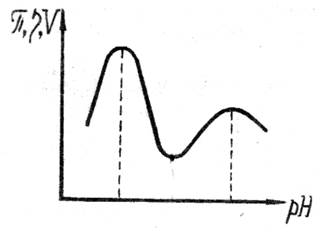
При определении рН раствора, когда количество ионизированных кислотных групп равно количеству ионизированных основных, молекулу можно считать не имеющей электрического заряда (изоэлектрическое состояние).
Значение рН, отвечающее изоэлектрическому состоянию, называется изоэлектрической точкой. В изоэлектрической точке полиионы, имеющие наименьший заряд, находятся в максимально изогнутой (клубкообразной) форме и оказывают наименьшее сопротивление течению. Вследствие этого в изоэлектрической точке растворы белков имеют минимальную вязкость.
Различают кислые, основные и нейтральные белки в зависимости от рН изоэлектрической точки. Основные белки – глиадин пшеницы, проламин. Кислые – желатин, альбумин.
 Макромолекулы белков способны к электрофорезу, что свидетельствует о наличии ДИС. Это обусловлено боковыми ответвлениями белковой молекулы.
Макромолекулы белков способны к электрофорезу, что свидетельствует о наличии ДИС. Это обусловлено боковыми ответвлениями белковой молекулы.
Под действием различных факторов может происходить изменение структуры макромолекул белка и его свойств, например, денатурация белка.
Денатурация белка связана с разрывом слабых связей внутри макромолекулы и нарушением нативной структуры белка. Денатурация проявляется у глобулярных белков и предшествует у них образованию студней, при этом макромолекулы вытягиваются в нити.
|
|
|
Так, например, введение в раствор желатина этилового спирта способствует разрыву внутримолекулярных связей и приводит к денатурации. В результате на зависимости объёмных свойств от рН наблюдается максимум.
Денатурация может происходить под действием температуры (тепловая денатурация, при варке яиц, в хлебопечении, варке мяса, рыбы), при механическом воздействии (сбивание яичного белка со сливками и превращение его в пену, при этом тонкие жидкие прослойки пены нарушают укладку полипептидных цепей, происходит их распрямление, которое сопровождается разрывом водородных связей). Денатурация может быть кислотной, например, при скисании молока кислоты разрушают слабые водородные связи внутри макромолекул и т.д.
При высаливании белков и других ВМС иногда наблюдается образование капель новой жидкой фазы, называемой коацерватом. Сам процесс выделения из раствора новой жидкой фазы, обогащённой ВМС, называется коацервацией. Причина этого явления в том, что некоторые ВМС и белки способны образовывать в растворе ассоциаты из нескольких макромолекул, которые при достижении определённых размеров могут выделиться в отдельную фазу. Коацервация может происходить при понижении температуры и не сопровождаться высаливанием. Впоследствии отдельные капли соединяются в более крупные агрегаты, и образуется слой с повышенным содержанием ВМС, способный к застудневанию.
Денатурация отличается от высаливания тем, что она необратима.
 2015-06-14
2015-06-14 6210
6210







