Понятие произведения растворимости связано с растворами малорастворимых сильных электролитов. Большинство малорастворимых электролитов в очень разбавленных растворах диссоциируют полностью, т.е. их можно рассматривать как сильные электролиты. Поэтому все приведенные ниже рассуждения относятся не только к растворам солей, но и к растворам оснований, таких как Al(OH)3, Fe(OH)3, Cu(OH)2,, Th(OH)4 и др.
При постоянной температуре в насыщенном растворе малорастворимого электролита устанавливается термодинамическое равновесие между твердой фазой и ионами в растворе:
K m А n (т) D K m А n (р) = m 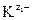 + n
+ n 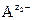 ,
,
или, с учетом полной диссоциации электролита:
K m А n (т) D m 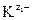 + n
+ n 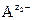 .
.
В случае очень низкой растворимости электролита образуется крайне разбавленный раствор, который можно считать идеальным и использовать концентрационную константу равновесия:
Kс = 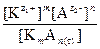 .
.
Концентрация твердой фазы [K m А n (т)]=const, отсюда:
Kс [K m А n (т)] = [ 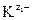 ] m [
] m [ 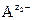 ] n = ПР = const. (9)
] n = ПР = const. (9)
При постоянной температуре в насыщенном растворе произведение концентраций (или активностей) ионов, на которые диссоциирует электролит, с учетом степеней, соответствующих стехиометрическим коэффициентам, есть величина постоянная. Она называется произведением растворимости (ПР) малорастворимого электролита.
Чем меньше значение ПР, тем хуже растворяется соединение. При внесении в раствор избытка ионов 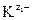 или
или 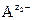 выпадет дополнительное количество осадка, изменятся концентрации ионов в растворе (сдвиг равновесия диссоциации влево по принципу Ле-Шателье), но величина ПР останется постоянной при неизменной температуре.
выпадет дополнительное количество осадка, изменятся концентрации ионов в растворе (сдвиг равновесия диссоциации влево по принципу Ле-Шателье), но величина ПР останется постоянной при неизменной температуре.
Условием образования осадка является превышение произведения концентраций ионов над величиной произведения растворимости: Сm (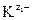 )× Сn (
)× Сn (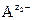 ) > ПР. Когда в растворе Cm (
) > ПР. Когда в растворе Cm (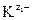 )× Cn (
)× Cn (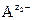 ) < ПР, то электролит будет растворяться до тех пор, пока произведение концентраций ионов не сравняется со значением ПР.
) < ПР, то электролит будет растворяться до тех пор, пока произведение концентраций ионов не сравняется со значением ПР.
Растворимость S, равная молярной концентрации насыщенного раствора, и произведение растворимости ПР малорастворимого электролита взаимосвязаны. Из стехиометрии реакции
K m А n (т) D m 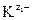 + n
+ n 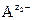 .
.
Следует, что молярные концентрации ионов насыщенного раствора связаны с растворимостью соотношениями:
K m А n (т) D m 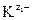 + n
+ n 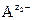 .
.
Если коичество моль K m А n (т), растворившихся в 1 л раствора = S, то количество образовавшихся ионов тогда
[ 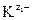 ]= mS и [
]= mS и [ 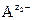 ]= nS.
]= nS.
Следовательно:
ПР = (mS) m (nS) n (степени из закона действующих масс, см. ур. Для ПР выше). (10)
Если в растворе появляются одноименные ионы (добавляем вещество, которое диссоциирует на 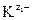 или
или 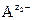 ), то происходит смещение равновесия (мы добавили продукты) и устанавливаются новые равновесные концентрации ионов, в то время как ПР остается постоянным.
), то происходит смещение равновесия (мы добавили продукты) и устанавливаются новые равновесные концентрации ионов, в то время как ПР остается постоянным.
Пусть в 1 л раствора в котором уже установилось равновесие
K m А n (т) D m 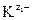 + n
+ n 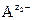 .
.
Добавили 0,01 моль KY (сильный электролит, который хорошо растворяется в воде). Появляющиеся одноименные ионы смещают равновесие в сторону исх. вещества K m А n (т), т.е. его растворимость уменьшается и равновесные концентрации ионов меняются.
Пусть новое значение растворимости K m А n (т) равно J (моль/л), тогда
ПР = (mJ+0,01) m (nJ) n
 2015-06-14
2015-06-14 1209
1209
