Пример 1. Рассчитайте состав раствора бензол-толуол, который при нормальном давлении кипит при температуре 1000С, а также состав образующегося пара. Раствор считайте идеальным. Давления пара чистых бензола и толуола при 1000С равны 1350 Торр и 556 Торр соответственно.
Решение: Мольную долю бензола в растворе находим по закону Рауля (21):
760 = 556 + (1350-556)х1, откуда х1 = 0,257.
Мольная доля толуола в растворе равна х2 = 1-х1 = 0,743.
Мольную долю бензола в газовой фазе находим по закону Дальтона (18):
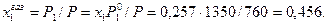
Соответственно мольная доля толуола в паре: 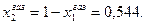
Пример 2.
Мольные объемы CCl4 и C6H6 равны 0,09719 и 0,08927 л/моль соответственно, а их парциальные мольные объемы в эквимолярном растворе равны 0,10010 и 0,10640 л/моль. Рассчитайте мольный объем эквимолярного раствора и изменение объема при смешении.
Решение: Объем 1 моля раствора определим по формуле (36):
Vm = 0,5·0,10010 + 0,5?0,10640 = 0,10325 (л/моль).
Объем до смешения: V0 = 0,5·0,09719 + 0,5?0,089274 = 0,09323 (л/моль).
?Vmix = Vm - V0 = 0,01002 (л/моль) – наблюдается увеличение объема раствора при смешении, т. е. положительные отклонения от закона Рауля.
|
|
|
Пример 3.
Рассчитайте растворимость висмута в кадмии при 150 и 2000С. Энтальпия плавления висмута при температуре плавления (2730С) равна 10,5 кДж/моль и не зависит от температуры. Считайте, что образуется идеальный раствор.
Решение: Воспользуемся формулой (51):
при 1500С 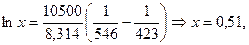
при 2000С 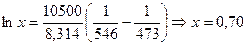 .
.
Растворимость увеличивается с температурой, что характерно для эндотермического процесса.
Пример 4.
Раствор 20 г гемоглобина в 1 л воды имеет осмотическое давление 7,52·10-3 атм при 250С. Определите молярную массу гемоглобина.
Решение: В уравнении (47) выразим молярную концентрацию как С=m/MV (m – масса гемоглобина в растворе, а М – его молекулярная масса), получим 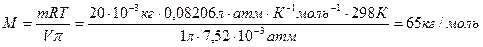 .
.
Обратите особое внимание на соответствие размерностей всех величин в формуле (47). При использовании величины R= 8,314 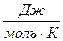 следует выразить осмотическое давление в Па, а молярную концентрацию в
следует выразить осмотическое давление в Па, а молярную концентрацию в 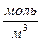 .
.
Пример 5.
Проба нелетучей жирной кислоты с общей формулой CnH2n-3COOH массой 1,263 г растворена в 500 г CCl4. Температура кипения раствора составила 76,8040С. Определите, какая кислота была исследована, если Ткип (ССl4)=76,760С, а эбуллиоскопическая постоянная 4,88.
Решение: По формуле (46) 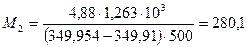 .
.
Индекс n находим, решая уравнение: 12n + 1(2n-3) + 12 + 2?16 +1 = 280, откуда n = 17. Исследована линолевая кислота C17H31COOH (витамин F).
Пример 6.
Давление пара воды при 273 К равно 610,48 Па, а давление пара 10% раствора NaNO3 589,28 Па. Определите активность, коэффициент активности и химический потенциал воды в растворе.
Решение: активность растворителя в неидеальном растворе можно рассчитать по закону Рауля 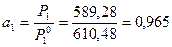 , а коэффициент активности из соотношения
, а коэффициент активности из соотношения 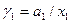 .
.
Мольная доля воды в растворе 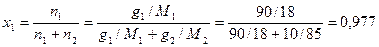 , тогда
, тогда 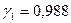 .
.
|
|
|
Химический потенциал воды в реальном растворе: 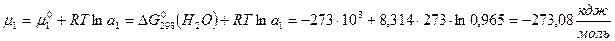 .
.
Варианты заданий самостоятельной работы по теме «Растворы»
| № в-та | Задачи | ||||||||||||||||||
1. Рассчитайте активность и коэффициент активности воды в растворе, образующемся при растворении 0,122 кг нелетучего вещества (М=241 г/моль) в 0,920 кг воды при 293 К, если известно, что давление пара чистой воды равно 0,02308 атм, а над раствором – 0,02239 атм. 2. При распределении фенола между водой и бензолом получены следующие данные (моль/л):
Вычислите константу распределения К и показатель степени n в формуле, описывающей закон распределения. | |||||||||||||||||||
1. Плотность 50% (по массе) раствора этанола в воде при 250С равна 0,914 г/см3. Рассчитайте парциальный мольный объем этанола в растворе, если парциальный мольный объем воды 17,4 см3/моль 2. При распределении уксусной кислоты между тетрахлоридом углерода и водой были получены следующие концентрации (кг/м3):
Уксусная кислота в водном растворе имеет нормальную молекулярную массу. Определите молекулярную массу кислоты в растворе CCl4 и коэффициент распределения К. | |||||||||||||||||||
| 1. Давление пара чистых CHCl3 и CCl4 при 250С равны 26,54 и 15,27 кПа. Полагая, что они образуют идеальный раствор, рассчитайте давление пара и состав (в мольных долях) пара над раствором, состоящим из 1 моль CHCl3 и 1 моль CCl4. 2. Белок сывороточный альбумин человека имеет молярную массу 69 кг/моль. Рассчитайте осмотическое давление раствора 2 г белка в 100 см3 воды при 250С в Па. Примите плотность раствора 1 г/см3. | |||||||||||||||||||
| 1. При 800С плотность 12% раствора фенола в воде равна 0,9775 г/см3. Какое количество моль воды приходится на 1 моль фенола? Чему равен удельный объем фенола, если удельный объем воды 1,029 см3/г, и образование раствора происходит без изменения объема? 2. Давление пара воды при 293 К равно 2338,5 Па, давление пара раствора 2295,8 Па. Определите осмотическое давление при 313 К, если плотность раствора при этой температуре 1010 кг/м3. Молекулярная масса растворенного вещества равна 60 г/моль. | |||||||||||||||||||
| 1. Плотность CS2 при 293 К равна 1,264 г/см3, плотность C2H5OH - 0,8040 г/см3. Чему равна плотность смеси, содержащей 80% CS2, если удельный объем ее является аддитивной функцией состава? 2. Водный раствор вещества замерзает при 271,5 К. Определите его температуру кипения и давление при 298 К, если криоскопическая константа воды 1,86, а эбуллиоскопическая константа воды 0,516. Давление пара воды при 298 К равно 3168 Па. | |||||||||||||||||||
| 1. Плотность 10% раствора NH4Cl равна 1,029 г/см3, плотность кристаллического NH4Cl – 1,536 г/см3, плотность воды – 0,9974 г/см3. Определите изменение объема при образовании 100 г 10% раствора. 2. При давлении 1,01?105 Па температура кипения диэтилового эфира 308 К. Раствор, содержащий 0,01094 кг анилина в 0,1 кг эфира, имеет давление пара 0,444?105 Па при 288,46 К. Удельная теплота испарения эфира 375,70?103 Дж/кг. Вычислите молекулярную массу анилина в растворе. | |||||||||||||||||||
| 1. При 293 К плотность C2H5OH равна 0,7936 г/см3, плотность воды – 0,9991 г/см3, плотность 50% раствора спирта в воде – 0,9179 г/см3. Определите величину сжатия при смешении 50 г спирта и 50 г воды, если удельный объем воды не изменяется при смешении. Сравните удельный объем чистого спирта с его удельным объемом в растворе. 2. Рассчитайте моляльность водного раствора вещества, если давление его пара 1,0109?105 Па при 373 К, давление паров воды при этой температуре 1,0264?105 Па. Молярная теплота испарения воды 40193 Дж/моль, эбуллиоскопическая постоянная воды 0,516. | |||||||||||||||||||
| 1. При смешении 125,4 г висмута с 9,73 г магния выделилось 16200 Дж теплоты. Определите парциальную мольную теплоту растворения висмута, если парциальная мольная теплота растворения магния в этом растворе равна – 34900 Дж/моль. 2. Вычислите температуру замерзания водного раствора, если давление его пара составляет 99% от давления пара чистой воды при этой же температуре. Теплота плавления льда 6029 Дж/моль. | |||||||||||||||||||
| 1. Температура замерзания разбавленного водного раствора тростникового сахара 272,171 К. Давление пара чистой воды при этой температуре 568,6 Па, а теплота плавления льда 6029 Дж/моль. Вычислите давление пара раствора. 2. Зависимость удельного объема Vуд водного раствора H2O2 от массовой доли перекиси w выражается уравнением: Vуд = 1,003(1 - w) + 0,6935w – 0,036w(1 - w). Рассчитайте парциальные молярные объемы воды и перекиси водорода для раствора с w=0,4. | |||||||||||||||||||
| 1. При 180С общий объем раствора, образующегося при растворении MgSO4 в 1 кг воды, описывается уравнением: V(см3) = 1001,21 + 34,69(m – 0,07)2. Рассчитайте парциальные мольные объемы компонентов при m = 0,5. 2. Определите концентрацию водного раствора глюкозы, если он при 291 К изоосмотичен с раствором, содержащим 0,5 моль/л CaCl2, причем кажущаяся степень диссоциации последнего составляет 65,4%. | |||||||||||||||||||
1. Температура плавления фенола 314 К. Раствор, содержащий 0,77 г ацетанилида (C8H9))N в 1,254 г фенола, кристаллизуется при 310,25 К. Вычислите криоскопическую константу фенола (сравните ее со справочной величиной) и удельную теплоту плавления фенола, если молекулярная масса ацетанилида соответствует его формуле. 2. При 298 К интегральная теплота растворения некоторой кислоты в воде выражается формулой: 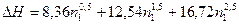 , где n1 – число молей воды на 1 моль кислоты. Оцените , где n1 – число молей воды на 1 моль кислоты. Оцените  раствора, молярное содержание которого составляет 10% кислоты. раствора, молярное содержание которого составляет 10% кислоты. | |||||||||||||||||||
| 1. Парциальные молярные теплоты растворения кремния и марганца в сплаве Si – Mn с молярным содержанием Si 70% равны -3800 и -83500 Дж/моль соответственно. Определите количество теплоты, выделяющееся при образовании 1 кг сплава этого состава. 2. Этанол и метанол при смешении образуют практически идеальные растворы. При 200С давление пара этанола равно 5,93 кПа, а метанола 11,83 кПа. Рассчитайте давление пара раствора, состоящего из 100 г этанола и 100 г метанола, а также состав (в мольных долях) пара над раствором при 200С. | |||||||||||||||||||
| 1. Определите массу 1 моль раствора, полученного смешением 1 моль CCl4 с 3 моль SnCl4. 2. Раствор, содержащий 1,632 г трихлоруксусной кислоты в 0,1 кг бензола, кристаллизуется при температуре на 0,3500 ниже, чем чистый бензол. Определите, происходит ли диссоциация или ассоциация трихлоруксусной кислоты в бензольном растворе и в какой степени. Криоскопическая константа бензола 5,16. | |||||||||||||||||||
| 1. Определите молярный объем сплава Cu - Zn, содержащего 62% Cu, считая объем аддитивной функцией состава. Плотности меди и цинка 8,9 и 7,1 г/см3 соответственно. 2. Давление пара раствора тростникового сахара в 1 кг воды составляет 98,88% от давления пара чистой воды при той же температуре. Вычислите температуру кипения и осмотическое давление этого раствора при 373 К, плотность раствора примите 1·103 кг/ м3. | |||||||||||||||||||
| 1. К очень слабым водным растворам для предотвращения замерзания в зимнее время обычно добавляют глицерин. Допустив, что к таким растворам применим закон Рауля, вычислите количество глицерина, которое необходимо прибавить, чтобы водный раствор, содержащий 0,1 кг воды, не замерзал до 268,16 К. 2. Определите плотность 40% водного раствора метилового спирта, если парциальные мольные объемы воды и спирта в этом растворе соответственно 17,5 и 39 см3/моль. | |||||||||||||||||||
| 1. Рассчитайте температуру, при которой замерзнет вода в стакане объемом 250 см3, если в ней растворить 7,5 г сахарозы. Криоскопическая константа воды 1,86. 2. Определите молярный объем раствора, если в 20% водном растворе метилового спирта парциальные мольные объемы воды и спирта равны 18 и 37,8 см3/моль соответственно. | |||||||||||||||||||
| 1. Температура замерзания чистого бензола 278,500 К, а температура замерзания раствора, содержащего 0,2242 г камфоры в 30,55 г бензола, 278,254 К. Определите молекулярную массу камфоры, сравните со справочной величиной. Молярное понижение температуры кристаллизации бензола 5,16. 2. Константа Генри для CO2 в воде при 250С равна 1,25?106 Торр. Рассчитайте растворимость (в единицах моляльности) CO2 в воде при 250С, если парциальное давление CO2 над водой равно 0,1 атм. | |||||||||||||||||||
| 1. Определите кажущуюся степень диссоциации HJO3 в растворе, содержащем 0,506 г HJO3 в 22,48 г этилового спирта. Раствор кипит при 351,624 К, чистый этиловый спирт кипит при 351,46 К. Эбуллиоскопическая постоянная спирта 1,19. 2. Вычислите активность воды в растворе, если давление водяных паров над ним равно 0,9333?105 Па при 373 К. Давление паров воды при этой температуре составляет 1,01325?105 Па. | |||||||||||||||||||
| 1. В 1 кг воды растворено 0,0684 кг сахара (М=342 г/моль). Вычислите давление пара этого раствора при 373 К. Рассчитайте температуру кипения раствора, если теплота испарения воды при температуре кипения равна 2256,7?103 Дж/кг. 2. Плотность 50% раствора этанола в воде при 250С равна 0,914 г/см3. Рассчитайте парциальный мольный объем спирта в этом растворе, если парциальный мольный объем воды равен 17,4 см3/моль. | |||||||||||||||||||
| 1. Разбавленный раствор брома в тетрахлориде углерода можно считать идеальным. Давление пара чистого CCl4 составляет 33,85 мм рт. ст. при 298 К. Если выражать концентрацию раствора в мольных долях Br2, то константа Генри оказывается равной 122,36 мм рт. ст. Рассчитайте давление пара каждого компонента, полное давление и состав пара при условии, что мольная доля брома 0,5 и раствор при данной концентрации является предельно разбавленным. 2. Определите молярный объем раствора, если в 20% водном растворе метилового спирта парциальные молярные объемы воды и спирта равны соответственно 18 и 38,7 см3/моль. | |||||||||||||||||||
1. Парциальный мольный объемK2SO4 в водном растворе при 250С описывается выражением: 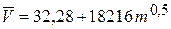 (см3/моль), где m - моляльность раствора. Рассчитайте объем раствора и его мольный объем при m=0,05 (моль/ кг H2O). Парциальный мольный объем воды равен 18,079 см3/моль. 2. Растворимость газообразного HBr в бензоле при 303 К характеризуется следующими данными: (см3/моль), где m - моляльность раствора. Рассчитайте объем раствора и его мольный объем при m=0,05 (моль/ кг H2O). Парциальный мольный объем воды равен 18,079 см3/моль. 2. Растворимость газообразного HBr в бензоле при 303 К характеризуется следующими данными:
Рассчитайте графически среднее значение постоянной Генри.
| |||||||||||||||||||
| 1. Определите процентный состав и молекулярную массу углеводорода на основании следующих данных: из 0,2 г вещества образуется 0,687 г CO2 и 0,1125 г H2O; температура замерзания раствора, содержащего 0,0925 г вещества в 0,01 кг бензола, ниже температуры замерзания бензола на 0,3540. Криоскопическая постоянная бензола 5,16. 2. Вычислите коэффициент активности брома в растворе тетрахлорида углерода, парциальное давление брома над которым соответствует 10,27 мм рт. ст. Мольная доля брома в растворе 0,025, а давление пара чистого брома 213 мм рт. ст. За стандартное состояние брома примите чистый жидкий бром. | |||||||||||||||||||
| 1. При 288 К водный раствор янтарной кислоты, содержащий 12,1 г/л кислоты, находится в равновесии с эфирным раствором, содержащим 2,2 г/л кислоты. Какова концентрация эфирного раствора янтарной кислоты, равновесного с водным раствором, содержащим 4,84 г/л кислоты. Янтарная кислота имеет нормальную молекулярную массу и в воде, и в эфире. 2. Бензол и толуол образуют практически идеальный раствор. Температура кипения чистого бензола равна 80,10С. Рассчитайте разность химических потенциалов бензола в растворе и в чистом виде при температуре кипения и хбензола=0,30. Чему было бы равно давление пара бензола над реальным раствором, если бы коэффициент активности бензола составлял 0,93? | |||||||||||||||||||
| 1. Если 1,046 г кадмия растворить в 25,23 г ртути, то давление пара образующейся амальгамы при 305,2 К составит 0,92 от давления чистой ртути. Определите активность и коэффициент активности (мол. доли) ртути в амальгаме. 2. Температура кипения бензола 353,36 К, его молярная теплота испарения при температуре кипения 30795 Дж/моль. Определите эбуллиоскопическую константу бензола. | |||||||||||||||||||
1. Хлорид ртути Hg2Cl2 распределяется между бензолом и водой, при 298 К получены следующие концентрации (моль/л):
Рассчитайте активность соли в водном растворе при концентрации 0,2866 моль/л, если ее раствор в бензоле остается идеальным до С=0,03 моль/л. 2. Определите процентную концентрацию водного раствора глицерина, если давление пара этого раствора равно давлению пара раствора, содержащего 0,0089 кг NaNO3 в 1 кг воды. Степень диссоциации соли в растворе 64,9 %. |
 2015-06-14
2015-06-14 26655
26655