Рис. 1.3 Схема-граф материальных потоков химического производства
Далее приведены примеры материальных расчетов химического производства, выполненных по вышеизложенной методике.
ПРИМЕРЫ МАТЕРИАЛЬНЫХ РАСЧЕТОВ
Пример 1. Материальный баланс производства 4-амино-6-хлорпиримидина.
1.1. Краткое описание процесса.
4-Амино-6-хлорпиримидин (АХП - полупродукт производства сульфамоно- метоксина - получают взаимодействием 4,6-дихлорпиримидина (ДХП) с водным раствором аммиака при 500С и избыточном давлении 0,1 - 0,2 МПа. После охлаждения и удаления из реакционной массы избытка аммиака АХП отфильтровывают, промывают на фильтре водой и сушат до остаточной влажности не более 2%. Технический продукт передают на следующую стадию производства сульфамонометоксина.
Составим схему - граф материальных потоков данного производства.
Схема - граф материальных потоков производства АХП
| Gаммиака | Gводы | Gлетучих | |||||||||||
 Gдхп Gдхп
| Узел 1 | Gр.м. | Узел 2 | Gпасты | Узел 3 | Gтов.прод. | |||||||
  
| Реакция | Фильтрация | Сушка | ||||||||||
| аминиров. | h1 | и промывка | h2 | h3 | |||||||||
| Gфильтрата | Gпотерь АХП | ||||||||||||
1.2. Исходные данные.
|
|
|
1.2.1. Масштаб расчета - 1000 кг (1т) технического АХП.
1.2.2. Состав технического АХП: 100%-ного АХП - 97%;
влага - 2%;
примеси - 1%.
1.2.3. Стадии процесса и выходы по стадиям:
h1 - реакция аминирования ДХП - 83%
h2 - фильтрация и промывка АХП - 98%
h3 - сушка АХП - 99%
Общий выход: hобщ = h1* h2* h3 = 0,83 * 0,98 * 0,99 = 0,805 (80,5%).
1.2.4. Состав (g) и удельные загрузки сырья (g) кг/кг 100%-ного ДХП:
Состав ДХП технического: (gдхп) основное вещество - 75% (0,75),
(g влаги) влага - 20% (0,20),
(gприм) примеси - 5% (0,05).
Состав водного раствора аммиака: (gамм) аммиак - 25% (0,25),
(gводы) вода - 75% (0,75).
Удельная загрузка раствора аммиака (gамм. ) = 0,8 кг/кг.
Удельный расход воды на промывку АХП (gводы) = 2,1 кг/кг.
Доля аммиака, удаляемого из реакционной массы через систему улавливания:
а = 98 %.
1.2.5. Определение расхода ключевого продукта (ДХП):
Мольные массы ДХП и АХП: МДХП = 149, МАХП = 129,5.
Количество исходного ключевого вещества (ДХП) определяется из следующего соотношения:
GДХП = GАХП * МДХП / МАХП * h1 = 970 * 149 / 129,5*0,805 = 1386,4 кг
Масса технического ДХП:
G ТЕХН. ДХП = GДХП / g ДХП = 1386,4 / 0,75 = 1848,5 кг
Влаги в загруженном ДХП:
Gвл = GДХП * gвлаги = 1848,5 * 0,2 = 369,7 кг
Примеси, внесенные с исходным ДХП:
Gпр = GДХП * gприм = 1848,5 * 0,05 = 92,4 кг
1.2.6. Расчет материального баланса по стадиям (узлам).
Узел 1. Стадия аминирования ДХП.
|
|
|
Химизм процесса:
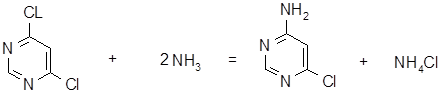
M. массы: 149 2 * 17 129,5 53,5
Проверка баланса мольных масс:
Мзагруж = 149+2*17 = 183 Мполуч = 129,5+53,5 = 183
Итак: Мзагруж = Мполуч
ЗАГРУЖЕНО (определение количеств загруженных веществ).
Из приведенного выше расчета загрузки исходного сырья следует:
ДХП технического.............................. GДХПтехн. = 1848,5 кг
в том числе:
ДХП 100%-ного................................GДХП = 1386,4 кг
влаги................................................…Gвлаги = 369,7 кг
примесей........................................…Gприм = 92,4 кг
Аммиака 100%-ного:...........................GАМ = GДХП * gАМ = 1386,4*0,8 = 1109,1 кг.
Водного раствора аммиака:................GВАМ = GАМ / gАМ = 1109,1/0,25 = 4436,5 кг.
масса воды в растворе аммиака: GВ = GВАМ - GАМ = 4436,5-1109,1 = 3327,4 кг.
Итого загружено в 1 узле:
G1загруж= GДХПтехн. + GВАМ = 1848,5 + 4436,5 = 6285,0 кг
ПОЛУЧЕНО (определение количеств полученных веществ).
Вступило в реакцию ключевого соединения (ДХП):
G РЕАГ ДХП = GДХП * h1 = 1386,4 * 0,83 = 1150,7 кг
Остаток непрореагировавшего ДХП:
GДХПост = GДХП - G РЕАГ ДХП = 1386,4 - 1150,7 = 235,7 кг
Вступило в реакцию аммиака:
GРЕАГ АМ = GРЕАГ ДХП * 2 * МАМ / МДХП = 1150,7 * 2 * 17 / 149 = 262,6 кг
Осталось непрореагировавшего аммиака:
G АМ НРЕАГ = GАМ - G РЕАГ АМ = 1109,1 - 262,6 = 846,5 кг
Количество аммиака, удаленного из реакционной массы через систему
улавливания: GАМскруб = GАМ НРЕАГ * а = 846,5 * 0,98 = 829,6 кг
Остаток аммиака в реакционной массе:
GАМост = GАМ НРЕАГ - GАМскруб = 846,5 - 829,6 = 16,9 кг
В результате реакции образуется.
Основного продукта АХП (4-амино-6-хлорпиримидина):
GАХП = GДХП * MАХП / МДХП = 1150,7 * 129,5 / 149 = 1000.1 кг
Хлористого аммония (второго продукта реакции):
GХА = GДХП * МХА / МДХП = 1150,7 * 53,5 / 149 = 413,2 кг
Без изменения остаются в реакционной массе:
Суммарная массы воды: GВсумм = GВ + GВЛ = 3327,4 +369,7 = 3697,1 кг
Примеси (внесенные с ДХП): Gприм = 92,4 кг
Количество реакционной массы, полученной в результате реакции:
Gрм = GАХП + GХА + GДХПост + GАМост + GВсумм + GПРИМ =
= 1000,1 + 413,2 + 235,7 + 16,9 + 3697,1 + 92,4 = 5455,4 кг
Итого получено суммарно в 1-м узле:
G1получ = Gрм + GАМскруб = 5455,4 + 829,6 = 6285,0 кг
Итак: G1загруж = G1получ
Результаты расчета по первому узлу сводятся в таблицу:
Материальный баланс реакции аминирования дихлорпиримидина Таблица 1.1
| Загружено (приход) | Получено (приход) | ||||
| Сырье и полупродукты | % | Масса, кг | Продукты, отходы, потери | % | Масса, кг |
| 1. ДХП технич. в том числе: ДХП Влага Примеси 2. Аммиак водный в том числе: Аммиак Вода | 1848,5 1386,4 369,7 92,4 4436,5 1109,1 3327,4 | 1. Реакционная масса в том числе: АХП ХА ДХП остаток Аммиак остаток Вода сумм. Примеси 2. Аммиак в систему улавливания | 18,3 7,5 4,3 0,3 67,8 1,7 100,0 | 5455,4 1000,1 413,2 235,7 16,9 3697,1 92,4 829,6 | |
| Итого: | 6285,0 | Итого: | 6285,0 |
Узел 2. Фильтрация и промывка АХП.
Выход на стадии: h2 = 0,98
Удельный расход воды на промывку АХП: gВОДЫ ПР = 2,1 кг/кг
Состав осадка после промывки: основного вещества (АХП) gАХП ПАСТ = 0,70
воды в пасте gв паст = 0,28
примеси gприм паст = 0,02.
ЗАГРУЖЕНО (определение количеств загруженных веществ):
Реакционная масса из 1-го узла: G1рм = 5455,4 кг
Вода на промывку: GВОДЫ ПР = GДХП * gВОДЫ ПР = 1386,4 * 2,1 = 2911,4 кг
Итого загружено: G2ЗАГР = G1рм + GВОДЫ ПР = 5455,4 + 2911,8 = 8366,8 кг
ПОЛУЧЕНО (определение количеств полученных веществ):
АХП в пасте: GАХП ПАСТ = GАХП * h2 = 1000,1 * 0,98 = 980,1 кг
АХП в фильтрате (потери): GАХП Ф = GАХП - GАХП ПАСТ = 20,0 кг
Влаги в пасте: GВ ПАСТ = GПАСТ * gВ ПАСТ = 1400,1 * 0,28 = 392,0 кг
Примеси в пасте: GПРИМ ПАСТ = GПАСТ * gПРИМ ПАСТ = 1400,1 * 0,02 = 28,0 кг
Всего получено пасты: GПАСТ = GАХП ПАСТ / gАХП ПАСТ = 980,1 / 0,7 = 1400,1 кг
Количество и состав фильтрата:
Вода: GВОДЫ Ф = (GВОДЫсумм - GВОДЫ ПАСТ) + GВОДЫ ПР =
= (3697,1 - 392,0) + 2911,4 = 6216,5 кг
Растворенные компоненты фильтрата суммарно:
Gр КОМП = (GПРИМ + GХА + GАМост + GДХПост + GАХП Ф) - GПРИМ =
= (92,4 + 413,2 + 16,9 + 235,7 + 20,0) - 28,0 = 750,2 кг
Масса фильтрата суммарно: GФ = GВОДЫ Ф + Gр КОМП = 6216,5 + 750,2 = 6966,7 кг
Итого получено во 2-м узле: G2ПОЛУЧ = GФ + GПАСТ = 6966,7 + 1400,1 = 8366,8 кг
|
|
|
Итак: G2ЗАГР = G2ПОЛУЧ
Материальный баланс фильтрации и промывки АХП Таблица 1.2
| Загружено | Получено | ||||
| Сырье и полупродукты | % | Масса,кг | Продукты, отходы, потери | % | Масса,кг |
| 1. Реакционная масса предыдущей стадии 2. Вода для промывки пасты | 5455,4 2911,4 | 1. Паста АХП в том числе: АХП Вода Примеси 2. Фильтрат в том числе: Вода Раств. компоненты | 70,0 28,0 2,0 89,2 10,8 | 1400,1 980,1 392,0 28,0 6966,7 6216,5 750,2 | |
| Итого: | 8366,8 | Итого: | 8366,8 |
Узел 3. Сушка пасты АХП и получение готового продукта.
Выход на стадии h3 = 0,99.
Состав АХП после сушки (товарный продукт):
Содержание основного вещества gАХП ПРОД = 0,97
Остаточная влага gВЛ ПРОД = 0,02
Примеси gПРИМ ПРОД = 0,01
Расход горячего воздуха по практическим данным составляет:
gВОЗД = 20 кг/кг пасты.
ЗАГРУЖЕНО:
Паста АХП из 2-го узла: GПАСТ = 1400,1кг
Горячий воздух: GВОЗД = GПАСТ * gВОЗД = 1400,1 * 20 = 28002,0кг
Итого загружено: G3ЗАГРУЖ = GПАСТ + GВОЗД = 1400,1 + 28002 = 29402,1кг
ПОЛУЧЕНО:
Основного вещества в товарном продукте:
GАХПпрод = GАХПпаст*h3 = 980,1*0,99 = 970,0кг
Механические потери АХП при сушке:
GАХПпот = GАХПпаст - GАХПпрод = 980,1-970 = 10,1кг
Масса товарного продукта:G ТОВ ПРОД = GАХП ПРОД / gАХП ПРОД =970,0 / 0,97 = 1000,0кг
Влаги в товарном продукте:GВЛ ПРОД = GТОВ ПРОД * gВЛ ПРОД = 1000,0 * 0,02 = 20,0кг
Примесей в товарном продукте:
GПРИМ ПРОД = GТОВ ПРОД*gПРИМ ПРОД = 1000,0 * 0,01 = 10,0кг
Летучие (воздух, влага, пылевидные компоненты):
Удаляемая влага: GВЛ ЛЕТ = GВЛ ПАСТ - GВЛ ПРОД = 392,0 - 20,0 = 372,0кг
Пылевидные компоненты: GПЫЛ КОМП = (GПРИМ ПАСТ - GПРИМ ПРОД) + GАХП ПОТ =
= (28,0 - 10,0) + 10.1 = 28,1кг
Всего летучих: GЛЕТ = GВОЗД + GВЛ ЛЕТ + GПЫЛ КОМП =
= 8002,0 + 372,0 + 28,1 = 28402,1кг
Итого получено в 3-м узле: G3ПОЛУЧ= GТОВ ПРОД+ GЛЕТ= 1000,0 + 28402,1 = 29402,1кг
Итак: G3ЗАГРУЖ = G3ПОЛУЧ
Материальный баланс сушки АХП Таблица 1.3
| Загружено | Получено | ||||
| Сырье, полупрод. | % | Масса,кг | Продукты,отходы,потери | % | Масса,кг |
| 1. Паста АХП в том числе: АХП Вода Примеси 2. Воздух | 1400,1 980,1 392,0 28,0 28002,0 | 1.Товарный продукт в том числе: АХП Влага Примеси 2.Влажный воздух в том числе: Воздух Влага Потери АХП Пылевидные примеси | 97,0 2,0 1,0 98,6 1,3 0,03 0,07 | 1000,0 970,0 20,0 10,0 28402,1 28002,0 372,0 10,1 18,0 | |
| Итого: | 29402,1 | Итого: | 29402,1 |
Расходные нормы сырья для производства 1 тонны товарного АХП Таблица 1.4
|
|
|
| Наименование сырья и материалов | Содержание осн.вещ. % | Расходная норма кг / 1т | |
| Масса техн. | Масса осн.вещ. | ||
| 1. 4,6-дихлорпиримидин 2. Водный раствор аммиака 3. Вода техническая (для промывки) 4. Воздух | - - | 1848,5 4436,5 2911,4 28002,0 | 1386,4 1109,1 - - |
| Материальный индекс произв - ва | МИ = 37198,4 кг / 1т |
Пример 2. Материальный баланс производства фталевого ангидрида непрерывным
методом.
1.3. Краткое описание процесса.
Фталевый ангидрид (ФА) в смеси с малеиновым ангидридом (МА) полу-чают путем высокотемпературного парофазного каталитического окисления орто-ксилола (ОК) кислородом воздуха (В). Часть ОК, при этом, сгорает до CO2 и Н2О.
1.3.1. Исходные данные
Состав товарного ФА: фталевого ангидрида 99,0 %
органических примесей 1,0 %
Масштаб расчета - часовой выпуск товарного ФА: Gчас = 3500 кг/час,
или чистого ФА: GФАчас = 3500*0.99 = 3465 кг/час.
Стадии процесса и выходы ФА по стадиям:
Окисление ОК h1 = 74,0 %
Конденсация ФА (получение ФА-сырца) h2 = 99,5 %
Дистилляция ФА-сырца (получение товарного ФА) h3 = 98,5 %
Общий выход: hОБЩ = 0,74 * 0,995 * 0,985 = 0,725 (72,5 %)
Доля ОК, превращающегося в МА................... 7,0 %
Доля ОК, сгорающего до СО2 и Н2О..............19,0 %
Массовое отношение Воздух: ОК = 30: 1 (кг/кг)
Содержание ФА в ФА-сырце.......................... 98,0 %
1.3.2. Расчет материального баланса по стадиям производства.
1.3.2.1. Стадия окисления ОК. Выход по стадии............ 74%.
Химизм процесса:
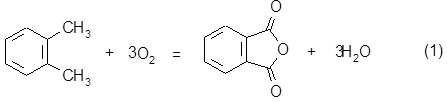
106 3*32 148 3*18
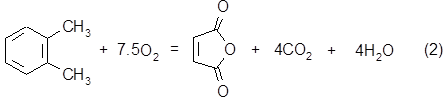
106 7,5 * 32 98 4 *44 4*18
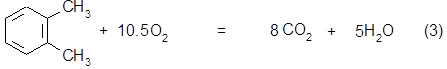
106 10,5 * 32 8 * 44 5 * 18
Определение количества загруженных веществ.
Часовой расход ОК составит: Gокчас = 3465*106 / 148*0,725 = 3423 кг/час
Часовой расход воздуха: Gвоздчас = 3423*30 = 102690 кг/час
Определение количества полученных веществ:
Часовое количество ФА составит:
GФАчас = 3423*0,74*148 / 106 = 3536,7 кг/час
Часовое количество МА составит:
GМАчас = 3423*0,07*98 / 106 = 221,5 кг/час
В результате реакций 2 и 3 образуется СO2:
GСО2час = 3423* (4*0,07 + 8*0,19)*44 / 106 = 2557,5 кг/час
В результате реакций 1 - 3 образуется H2O:
GH2Oчас = 3423 * (3*0,74+4*0,07+5*0,19)*18 / 106 = 2005,4 кг/час
Часовой расход О2 по реакциям 1 - 3 составит:
GO2час = 3423* (3*0,74+7,5*0,07+10,5*0,19)*32 / 106 = 4898,1 кг/час
Часовой остаток воздуха после реакции составит:
Gчасвозд = 102690,0 - 4898,1 = 97791,9 кг/час
Результаты расчетов по стадии окисления ОК сводятся в таблицу.
Материальный баланс окисления ОК: Таблица 1.5
| Загружено | Получено | ||||
| Сырье и полупродукты | % | Масса,кг | Продукты, отходы, потери | % | Масса,кг |
| Ксилоло-воздушная смесь в том числе: о-ксилол воздух | 3,23 96,77 | 106113,0 3423,0 102690,0 | Катализат в том числе: фталевый ангидрид малеиновый ангидрид СО2 Н2О отработанный воздух | 3,33 0,21 2,40 1,90 92,16 | 106113,0 3536,7 221,5 2557,5 2005,4 97791,9 |
| Итого: | 100,0 | 106113,0 | Итого: | 100,0 | 106113,0 |
1.3.2.2. Стадия конденсации ФА (получение ФА-сырца).
Выход по стадии......... 99,5 %.
На стадию поступает катализата: Gчас = 106113,0 кг/час,
в том числе ФА: Gчас = 3536,7 кг/час.
Определение количеств полученных веществ.
С учетом выхода по стадии будет получено чистого фталевого ангидрида:
GФАчас = 3536,7 * 0,995 = 3519 кг/час
Часовой выпуск ФА-сырца составит: Gчассырца = 3536,7 / 0,98 = 3590,8 кг/час
Часовое количество абгазов (АГ)составит: Gчасаг= 106113 - 3590,8 = 102522,2 кг/час
Материальный баланс стадии конденсации ФА Таблица 1.6
| Загружено | Получено | ||||
| Сырье и полупродукты | % | Масса,кг | Продукты, отходы, потери | % | Масса,кг |
| Катализат в том числе: фталевый ангидрид малеиновый ангидрид СО2 Н2О отработанный воздух | 3,33 0,21 2,40 1,90 92,16 | 106113,0 3536,7 221,5 2557,5 2005,4 97791,9 | 1. Фталевый ангидрид сырец в том числе: ФА примеси 2. Абгазы на улавлива- ние | 98,0 2,0 | 3590,8 3519,0 71,8 102522,2 |
| Итого: | 100,0 | 106113,0 | Итого: | 106113,0 |
1.3.2.3. Стадия дистилляции ФА-сырца (получение товарного ФА)
Выход по стадии............ 98,5 %.
На стадию дистилляции поступает фталевого ангидрида-сырца: Gчас= 3590,8 кг/час.
в том числе: GФАчас = 3519 кг/час; GПРИМчас = 71,8 кг/час.
Определение количеств полученных веществ.
С учетом выхода по стадии будет получено 100 %-ного фталевого ангидрида:
GФАчас = 3519*0,985=3465,0 кг/час.
Количество товарного ФА составит: Gчас = 3465 / 0,99 = 3500,0 кг/час.
Масса кубового остатка (КО) в час составит: Gчас = 3590,8 - 3500,0 = 90,8 кг/час.
Материальный баланс стадии дистилляции Таблица 1.7
| Загружено | Получено | ||||
| Сырье и полупродукты | % | Масса,кг | Продукты, отходы, потери | % | Масса,кг |
| Фталевый ангидрид-сырец в том числе: ФА примеси | 98,0 2,0 | 3590,8 3519,0 71,8 | 1.Фталевый ангидрид товарный в том числе: ФА примеси 2.Кубовый остаток | 99,0 1,0 | 3500,0 3465,0 35,0 90,8 |
| Итого: | 100,0 | 3590,8 | Итого: | 3590,8 |
Таким образом, для производства 1000кг товарного фталевого ангидрида потребуется: орто-ксилола: 3423*1000 / 3500 = 978кг
воздуха: 102690*1000 / 3500 = 29340кг
Расходные нормы сырья для производства 1т товарного фталевого ангидрида
Таблица 1.8
| Наименование сырья и материалов | Содерж-е осн.вещ. | Расходная норма кг / 1т | |
| % | Масса техн. | Масса осн. вещ. | |
| 1. Орто-ксилол 2. Воздух | - - | 978,0 29340,0 | 978,0 29340,0 |
| Материальный индекс производства | МИ = 30318,0 кг / 1т |
2. ТЕХНОЛОГИЧЕСКИЕ РАСЧЕТЫ
Цель технологических расчетов - определение производительности аппаратов, их объемов, количества и основных размеров. Исходными данными для технологических расчетов являются: годовая мощность производства (годовой объем выпускаемой продукции), суточная или (для непрерывных процессов) часовая производительность каждой ступени производства, длительность производственных операций (стадий).
Основной характеристикой аппарата для проведения жидкофазного процесса, определяющей производительность аппарата, является его объем. Ниже приводятся формулы для расчета объемов реакторов периодического и непрерывного действия.
2.1.1. Технологический расчет аппаратов периодического действия (РПД) [1-3].
Полный объем реактора РПД может быть рассчитан по формуле:
Va = Gгод*V1т*(1+z)*t / N*24*f*n,
где Vа - расчетный объем аппарата, м3;
Gгод - годовой выпуск продукции т;
N - количество рабочих суток в году;
V1т - объем реакционной смеси, перерабатываемой на данной стадии
производства для получения 1т товарного продукта, м3/т, V1т = G1т / r;
z - запас производительности (в долях единицы), учитывающий внеплано-
вые простои реактора; обычно z = 0,05 - 0,2;
t - период процесса, час;
f - коэффициент заполнения реактора, доли единицы;
n - число аппаратов, устанавливаемых на данной стадии технологического
процесса.
2.1.2. Расчет мерников.
Для расчета полного объема Vмер мерника можно рекомендовать формулу:
Vмер= Gопер / ri * fмер
где Gопер - масса операционной загрузки i-го вида сырья в реактор, кг/опер;
ri - плотность i-го вида сырья, кг/м3;
fмер - коэффициент заполнения мерника для i-го вида сырья, доли единицы
(как правило, f = 0,9);
2.1.3. Расчет объема хранилищ жидких веществ.
Полный объем хранилища для i-го вида жидкого сырья Vа рассчитывают по формуле: Vхран = Vcут*Y / fхран,
где Vсут - суточный объемный расход i-го вида сырья, м3/сутки;
Y - коэффициент запаса хранимого i-го вида жидкого сырья, сутки;
fхран-коэффициент заполнения хранилища, доли единицы (обычно равен 0,9).
Величина Y зависит от ограничений, обусловленных правилами техники безопасности, и от частоты поставок сырья в цех, и может составлять 2-30 суток. Величины fап приведены в таблице 2.1.
Рекомендуемые величины fап для различных аппаратов [1-3] Таблица.2.1
| Тип аппарата | fап |
| Хранилища, мерники и другие аппараты без перемешивания | 0.85- 0.90 |
| Аппараты, снабженные перемешивающими устройствами | 0.75-0.80 |
| Аппараты, для которых велика вероятность вспенивания, спон-танного увеличения объема или даже выброса реакционной массы | 0.40- 0.60 |
2.2. Технологический расчет реакторов непрерывного действия [1-5]
Рабочий объем Vр реактора непрерывного действия определяют по формуле:
Vp = Wcм * t
где Wсм -часовой объем подаваемой в реактор смеси реагентов, Wсм= Gсм / rсм,
м3/час;
t - время пребывания реакционной массы в реакторе, час.
Gcм - часовая масса смеси реагентов, т/час (из материального баланса соответ-
ствующей стадии).
rсм - плотность реакционной смеси, т/м3 (опытные данные).
Методы определения продолжительности реакции в РПВ(tв) или в РПС (tсм) описаны в [1,2,7,8].
Полный объем РПС Vа связан с его рабочим объемом Vр через коэффициент заполнения: Va = Vp / f
Рекомендуемые величины f приведены выше, а для РПВ f всегда равен 1.
Как и для случая РПД расчетный объем РПС Vарпс округляют до ближайшего стандартного объема: Vа рпс < Vгост.
При использовании в качестве РПВ трубчатки (в виде змеевика) после расчета Vp определяют диаметр трубы реактора dтр по формуле:
dтр = 4*Wссм*rсм / p*Re*m [1, c.456]
где Wссм - секундный объем реакционной смеси, подаваемой в реактор, м3/с,
Wссм = Wсм / 3600;
rсм - плотность реакционной смеси, кг/м3;
Re - критерий Рейнольдса, принимаемый с учетом требуемого характера
движения потока (при турбулентном движении Re >2300);
m - коэффициент динамической вязкости реакционной массы, Па*с.
Полученную расчетную величину dтр округляют до ближайшего большего значения условного прохода (dу) трубы по ГОСТ.
Выбрав dу, определяют линейную скорость движения реакционной массы в трубе-реакторе по формуле:
w = 4*Wссм / d2у, (м/с)
Длина реакционной зоны Lр трубчатого реактора рассчитывается по формуле:
Lp = w*tв, (м).
3. ТЕПЛОВЫЕ РАСЧЕТЫ
Целью теплового расчета реактора является:
- проверка достаточности поверхности теплообмена реактора путем сравнения величины расчетной поверхности (Fрасч) с имеющейся у выбранного аппарата геометрической теплообменной поверхностью Fгеом;
- определение расхода теплоносителя или охлаждающего агента;
- расчет необходимой толщины тепловой изоляции реактора.
3.1. Общее уравнение теплового баланса реактора
Все тепловые расчеты базируются на законе сохранения энергии (в данном случае тепловой).
Уравнение теплового баланса можно представить в следующем виде:
Q1 + Q2 + Q3 = Q4 + Q5 + Q6 (3.1)
Qприх = Qрасх
Размерности Q1, Q2, Q3, Q4, Q5, Q6 - кДж/опер или кДж/час.
где Q1 - теплосодержание смеси исходных веществ при загрузке в реактор,
Q2 - тепло, которое необходимо подвести к реакционной массе или отвести
от нее для обеспечения нужного температурного режима процесса
(искомая величина),
Q3 - тепловой эффект процесса,
Q4 - теплосодержание реакционной массы (продуктов реакции) при соот-
ветствующей температуре,
Q5 - расход тепла на нагревание реактора (не определяют для непрерывного
процесса вследствие малого вклада этой величины в тепловой баланс
проточного реактора),
Q6- тепловые потери в окружающую среду.
Тепловой баланс составляется на одну операционную загрузку реагентов при расчете периодического реактора и на часовую производительность - при расчете реактора непрерывного действия.
3.2. Расчет отдельных составляющих теплового баланса реактора.
3.2.1. Расчет Q1 и Q4.
Расчет этих величин производится по общей формуле:
Q(1,4) = Gi*Ci*Ti (3.2)
где Gi - масса i-го вещества, кг/опер или кг/час;
Ci - теплоемкость i-го вещества, кДж/кг*град;
Ti - температура i-го вещества, oК.
Теплоемкости веществ находят в справочной литературе [4], а при отсутст-вии справочных данных, вычисляют через атомные теплоемкости элементов [1,5].
Следует отметить, что величины теплоемкостей органических веществ с ковалентными связями (за исключением галогензамещенных углеводородов) находятся в интервале 1,26 - 1,68 кДж/кг*град.
При составлении теплового баланса мощностей тепловых потоков (в Вт) следует использовать секундные количества перерабатываемых веществ.
Температуры веществ Тi определяются регламентом производства.
3.2.2. Расчет величины Q3.
В величину Q3 включают собственно тепловой эффект химической реакции и теплоту физико-химических процессов, которые могут сопровождать химическое превращение: Q3 = Qp + Qфиз (3.3)
где Qр - теплота химической реакции, кДж/опер или кДж/час;
Qфиз - теплота физико-химических процессов (например, теплота раство-
рения, испарения и т.д.), кДж/опер или кДж/час.
Qр рассчитывают по формуле:
Qр = Gисх*qp*h*1000 / Мисх (3.4)
где Gисх - операционное или часовое количество ключевого вещества, определя-
ющего выход целевого продукта реакции, кг/опер или кг/час. Напом-
ним, что в данном случае под ключевым веществом следует понимать
тот реагент, который участвует в химической реакции в стехиометриче-
ском количестве.
Мисх - мольная масса ключевого вещества, кг/Кмоль;
qp - мольный тепловой эффект химической реакции, кДж/моль;
1000 - коэффициент пересчета Кмоль в моль,
h- практический выход продукта реакции, доли единицы.
Мольные теплоты некоторых химических реакций органических соединений приведены в справочной литературе [9].
При отсутствии литературных данных qp находят по формуле (следствие закона Гесса):
qр = Sqопрод - Sqоисх (3.5)
где qoпрод - теплоты образования продуктов реакции из элементов, кДж/моль;
qoисх - теплоты образования исходных веществ из элементов, кДж/моль;
Теплоты образования продуктов реакции и исходных реагентов могут быть найдены в справочниках физико-химических величин [4,5].
При отсутствии справочных данных qо органических соединений (ОС), находящихся в растворе или в жидкой фазе на основании закона Гесса находят по формуле: qo = Sn*qa - qсг (3.6)
где qa - теплота сгорания элемента, атомы которого входят в молекулу органиче-
ского соединения, кДж/моль;
n - число одноименных атомов в молекуле;
qсг - теплота сгорания органического соединения, кДж/моль.
Теплоты сгорания элементов, обычно входящих в состав органических молекул, приведены в таблице.
Теплоты сгорания элементов Таблица 3.1
| Элемент | qа | Элемент | qа |
| Углерод | 395,5 | Азот | |
| Водород | 144,6 | Кислород | |
| Хлор Бром, иод | Фтор Сера | 173,5 290,4 |
При отсутствии экспериментальных данных о qсг, их величины можно рассчитать по формуле Караша [1-3]:
qcг = 109.15*n + SD*z (3.7)
где: n - число электронов, перемещающихся к кислороду при сгорании атомов
элементов, образующих молекулу ОС;
D - тепловая поправка для соответствующего заместителя, кДж/моль;
z - число одинаковых заместителей в молекуле.
Величины тепловых поправок приведены в литературе [1-3]. Число электронов, перемещающихся к кислороду при сгорании атомов элементов, определяют по формуле:
n = C4*4 + C3*3 + C2*2 + C1*1 + H1*1 (3.8)
где: С4,С3,С2,С1 - число атомов углерода, в которых при сгорании перемещается
соответственно 4,3,2,1 электрон;
Н1 - число атомов водорода, в которых перемещаются электроны.
В число С1 включаются атомы углерода, входящие в состав карбоксильных или сложноэфирных групп:
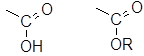
В число С2 входят атомы углерода в составе карбонильных групп:
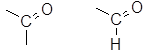
кетонная альдегидная
В число С3 включаются атомы углерода, связанные с заместителями С - Х,
где Х = -ОН; -ОR; галоген, сульфогруппа (-SO3H) и нитрогруппа (- NO2).
Все остальные атомы С в молекуле образуют число С4. Величина Н1 для гидроксильной группы (-ОН) равна нулю. Таким образом, для расчета qсг необходимо использовать структурную формулу органического соединения, а для расчета n*qa - его брутто-формулу.
При определении величины qо газообразного или твердого ОС вводят поправки на агрегатное состояние вещества. В этом случае:
qо = n*qa - qсг - qисп или qо = n*qa - qсг + qпл
где qисп - теплота испарения жидкого органического вещества, кДж/моль.
qпл - теплота плавления твердого вещества, (кДж/моль)
Теплоты испарения и плавления целесообразно брать из справочников, а при отсутствии информации их величины можно приближенно рассчитать по формулам:
qисп = Kисп*Tк / 1000, кДж/моль,
где Кисп = 88 + 4 - эмпирическая константа;
Тк - температура кипения вещества, град. Кельвина.
qпл = Кпл * Тпл / 1000, кДж/моль,
где: Кпл = 54 + 13 - эмпирическая константа;
Тпл - температура плавления, град. Кельвина.
Величины физических составляющих (Qфиз) теплового эффекта процесса (Q3 = Qр + Qфиз) определяют для конкретного типа реакции с учетом ее специфики (сульфирование, нитрование, галогенирование и т.д.) [1].
3.2.3. Расчет Q5.
Расход тепла на нагревание отдельных частей реактора периодического действия определяют по формуле: Q5 = Gi*Ci*(tкон - tнач)i,
где: Gi- массы отдельных частей аппарата и изоляции, кг;
Ci- теплоемкости материалов частей аппарата, кДж/кг*град;
tкон - конечная температура i-й части аппарата, град. Цельсия;
tнач - начальная температура i-й части аппарата, град. Цельсия.
Массы частей аппарата берутся из его технического паспорта, теплоемкости - из справочной литературы. Температуры отдельных частей аппарата определяются из конкретных данных температурного режима и условий нагревания или охлаждения.
В технических тепловых расчетах, допускающих определенную погрешность, при определении величины Q5 можно использовать следующие реко-мендации относительно конечных температур отдельных частей реактора. Темпе-ратуру мешалки можно принять равной температуре реакционной массы (tмеш = tрм). Конечную температуру стенки корпуса реактора, его крышки и стенки рубашки - равной температуре теплоносителя (пара). При использовании в качестве теплообменного устройства внутреннего змеевика температуру корпуса реактора можно приравнять к температуре реакционной массы, а температуру змеевика принять равной температуре теплоносителя.
Температуру наружной поверхности теплоизоляции при нагревании прини-мают равной 40 град. Цельсия (с учетом требований техники безопасности).
3.2.4. Расчет Q6 и необходимой толщины теплоизоляции.
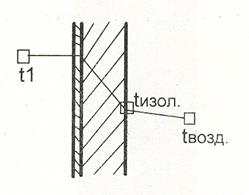
Для пояснения расчета Q6 и толщины теплоизоляции рассмотрим схему теплопередачи от теплоносителя через стенку рубашки и изоляцию к окружающей воздушной среде (рис 3.1).
|
tрм - температура реакционной массы,
t1 - температура теплоносителя,
tиз - температура наружной поверхно-
сти теплоизоляции,
tвозд- температура воздуха в произ-
водственном помещении (при-
нимается равной 20оС),
Рис.3.1.
Потери тепла от реактора в окружающую среду рассчитывают по формуле:
Q6 = aвозд*Fизол*t*(tизол - tвозд) (3.9)
где aвозд - коэффициент теплопередачи от стенки к воздуху, учитывающий пере-
дачу тепла как конвекцией, так и лучеиспусканием, Вт/м2*оК;
aвозд = 9.74 + 0.07*(tизол - tвозд) = 11.14 Вт/м2*оК (3.10)
Fизол - площадь поверхности изоляции реактора, через которую тепло теря-
ется в окружающую среду, м2,
t - продолжительность тепловой ступени процесса, с.
Для определения Fиз, а затем Q6, необходимо предварительно рассчитать тол- щину слоя теплоизоляции (dизол), при которой tизол будет равной 40оС. Эта задача решается следующим образом. Для установившегося (стационарного) процесса теплопередачи справедливо равенство:
Q6 = k*Fизол*t*(t1 - tвозд) = aвозд*Fизол*t*(tиз - tвозд) (3.11)
где k - общий коэффициент теплопередачи от теплоносителя к воздуху, Вт/м2*оК.
Величину k находят из вышеприведенного соотношения таким образом:
k= aвозд*(tизол - tвозд) / (t1 - tвозд).
С другой стороны, как следует из теории теплопередачи [6]:
k = 1 / aтепл-1 + dст / lст + dизол / lизол + aвозд-1 (3.12)
Вычислив величину k и подставив lизол для выбранного теплоизоляционного материала [6], из последнего выражения находят толщину слоя теплоизоляции dизол. С учетом толщины (dизол) изоляции определяют ее поверхность (Fизол) и затем рассчитывают Q6.
При известных значениях dизол и геометрических размерах реактора можно рассчитать объем и массу теплоизоляции, а также расход тепла на ее нагревание, что сделает более точным расчет Q5 (см. выше).
3.2.5. Расчет Q2 и необходимой поверхности теплопередачи Fрасч.
После вычисления Q2 = Q4 + Q5 + Q6 - Q1 - Q3 находят поверхность теплопередачи из известного соотношения: Fрасч = Q2 / k*Dtср*t, м2 (3.13)
где k - общий коэффициент теплопередачи от теплоносителя к реакционной массе,
Вт/м2*oК;
Dtср - средняя разность температур теплоносителя и реакционной массы,
t - продолжительность процесса, с.
Рекомендуемые величины k и формулы для их расчета приводятся в литера-туре [6].
При нагревании жидким теплоносителем и при охлаждении реактора перио-дического действия расчет величины tср имеет некоторые особенности (см. ниже).
3.3. Особенности теплового расчета реактора периодического действия.
Эти особенности связаны со ступенчатым изменением температуры в реакторе в ходе технологического процесса, а также с непостоянством температуры жидкого теплоносителя или охлаждающего агента на выходе из теплообменного устройства.
На рис.3.2 представлен пример графика изменения температуры в ходе технологического процесса в химическом реакторе периодического действия.
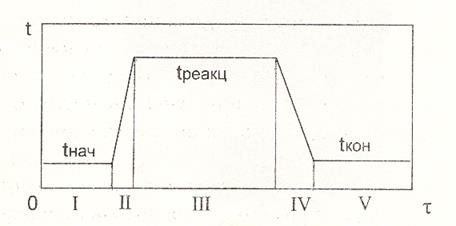 |
Рис.3.2
I - загрузка исходных веществ при температуре t1 (за время t1);
II - нагревание реакционной смеси до температуры начала реакции t3;
III - выдержка (химическая реакция) при постоянной температуре t3;
IV - охлаждение продуктов реакции до температуры t2;
V - выгрузка реакционной массы при температуре t2.
Общее уравнение теплового баланса преобразуется для каждой ступени тем-пературного режима процесса, как показано далее:
I ступень: составление теплового баланса не требуется;
II ступень: Q1 + Q2 + Q3 = Q4 + Q5 + Q6 ----- Q2 = Q4 + Q5 - Q1;
III ступень: Q1 + Q2 + Q3 = Q4 + Q5 + Q6 ----- Q2 = Q6 - Q3;
IV ступень: Q1 + Q2 + Q3 = Q4 + Q5 + Q6 ----- Q2 = Q4 + Q5 - Q1;
V ступень: составление теплового баланса не требуется;
Отметим, что в случае ступенчатого температурного режима периодиче-ском реакторе Q1- это теплосодержание реакционной смеси в начале ступени, а Q4- теплосодержание реакционной массы в конце ступени.
Достаточность поверхности теплопередачи Fрасч = Q2 / k*(Dtср)i*t проверя-ется для каждой (i-той) ступени процесса.
Полученные величины Fрасч и Fгеом должны быть связаны соотношением: Fрасч < Fгеом.
3.3.1. Расчет величины Dtср, расхода теплоносителя или охлаждающего агента.
А. Нагревание РПД насыщенными парами теплоносителя.
Расчет Dtср осуществляется по широко известной формуле:
Dtср = Dtб - Dtм / ln(Dtб / Dtм) (3.14)
где Dtб и Dtм - большая и меньшая разности температур теплоносителя и реакционной ной массы в начале и в конце процесса (температурной ступени).
Расход пара определяют по формуле:
Gпара = Q2 / iп - iк (3.15) где iп и iк - теплосодержания пара и конденсата (кДж/кг) при выбранном давлении [6].
Б. Нагревание РПД жидким теплоносителем (горячей водой, жидкой дифенильной смесью и т.д.).
Вследствие непостоянства конечной температуры жидкого теплоносителя (на выходе из теплообменного устройства) расчет Dtср производят по формуле [6]:
Dtсрнагрев = (t2 - t1)*(A-1/A*lnA) / ln(T1 - t1 / T1 - t2); A = T1 - t2 / T2 - t2,
где t1 - начальная температура реакционной массы, град.Цельсия;
t2 - конечная температура реакционной массы, град.Цельсия;
T1 - начальная температура жидкого теплоносителя, град. Цельсия,
Т2 - конечная температура теплоносителя, град. Цельсия.
Принимается условие: T2 > t2.
Расход жидкого теплоносителя определяют по формуле:
Gжтепл = Q2 / cтепл*(T1-T2ср), кг (3.16)
где T2ср - средняя за процесс температура теплоносителя на выходе из тепло-
обменнго устройства, град. Цельсия.
Т2ср = Т1 - tср* lnА (3.17)
В. Охлаждение РПД.
Температура охлаждающего агента (воды, рассола) на выходе из тепло-обменного устройства в периодическом процессе непрерывно изменяется и становится равной Т2 в конце процесса (тепловой ступени), когда температура охлаждаемой реакционной массы станет равной t2, причем (t2 < T2) [6].
Dtсрохл = (Т1-Т2)*(A-1/A*lnA) / ln(T1 - t1/T2 - t1); A = T2 - t1/T2 - t2 (3.18)
где Т1 - начальная температура охлаждаемой реакционной массы, град. Цельсия;
Т2 - конечная температура реакционной массы, град. Цельсия;
t1 - начальная температура охлаждающего агента, град. Цельсия;
t2 - конечная температура охлаждающего агента, град. Цельсия.
Принимается условие: t2 > T2.
Расход охлаждающего агента определяют по формуле:
Gжохл = Q2 / сжохл *(t2ср - t1), кг/опер или кг/час (3.19)
где Т2ср - средняя за процесс температура охлаждающего агента на выходе из
теплообменного устройства, град. Цельсия,
t2ср = t1 + Dtсрохл * lnА.
Результаты теплового расчета теперь могут быть использованы для проектирования технологической установки.
Библиографический список
1. Плановский А.Н., Гуревич Д.А.
Аппаратура промышленности полупродуктов и красителей. М.: Госхимиздат, 1961.504с.
2. Батунер Л.М.
Процессы и аппараты органического синтеза и биохимической технологии. М.: Химия, 1976. 519с.
3. Гуревич Д.А.
Проектные исследования химических производств. М.: Химия, 1976. 208с.
4. Бесков С.Д.
Технохимические расчеты. М.: Высшая школа, 1966. 520с.
5. Краткий справочник физико-химических величин. Под ред. Равделя А.А.
Л.: Химия, 1983. 232с.
6. Павлов К.Ф., Романков П.Г., Носков А.А.
Примеры и задачи по курсу процессов и аппаратов химической технологии.
Л.: Химия, 1987.576с.
7. Лебедев Н.Н., Манаков М.Н., Швец В.Ф.
Теория химических процессов основного органического и нефтехимического синтеза. М.: Химия, 1984. 376с.
8. Михаил Р., Кырлогану К.
Реакторы в химической промышленности. Л.: Химия, 1968. 388с.
9. Альперт Л.З.
Основы проектирования химических установок. М.: Высшая школа, 1989.
304с; ил.
10.ГОСТ 9934-85 Корпуса цилиндрических стальных сварных сосудов и аппаратов,
типы, основные параметры и размеры. Введено 01.01.86. М.: Изд-во стан-
дартов, 1985. 18с.
Дополнительная литература
1. Беркман Б.Е.
Основы технологического проектирования производств органического синтеза. М.: Химия, 1970.366с.
2. Генкин А.Э.
Оборудование химических заводов. М: Высшая школа, 1986. 280с.
3. Гурвич Л.В.
Энергии разрыва химических связей, потенциалы ионизации и сродство к элек- трону. М: Наука, 1974. 351с.
4. Перевалов В.П., Колдобский Г.И.
Основы проектирования и оборудование производств тонкого органического синтеза. М: Химия, 1997. 288с. ил.
5. Флореа О., Смигельский О.
Расчеты по процессам и аппаратам химической технологии. М.: Химия, 1971. 448с.
 2015-06-16
2015-06-16 842
842