Химическая кинетика изучает закономерности протекания химических процессов во времени.
Скорость химической реакции (n) – это количество вещества (Dn), реагирующего или образующегося в результате реакции в единицу времени (Dt) в единице объема реакционного пространства (V):
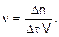 (1)
(1)
Количество вещества в единице объема (Dn/V) – это молярная концентрация С.
Тогда скорость реакции можно записать:
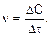 (2)
(2)
Единицей измерения скорости является моль•л-1•с-1.
Для гетерогенной реакции скорость зависит от площади поверхности раздела фаз (S):
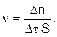 (3)
(3)
Размерность скорости - моль•м-2•с-1.
Различают среднюю и мгновенную скорости.
Средняя скорость описывается уравнением
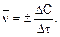 (4)
(4)
О скорости реакции можно судить, измеряя концентрацию исходных веществ или продуктов. Концентрация исходного вещества с течением времени постепенно уменьшается и DС имеет знак «-», а концентрация продукта увеличивается и DС имеет знак «+».
Если взять бесконечно малый отрезок времени dt, то получим выражение для мгновенной скорости в любой конкретный момент времени
|
|
|
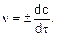 (5)
(5)
На скорость реакции влияют следующие факторы:
1. Природа реагирующих веществ – характер химических связей в соединениях, строение молекул.
2. Концентрация реагирующих веществ. Скорость химической реакции, при прочих равных условиях, зависит от числа столкновений реагирующих частиц в единицу времени. Вероятность столкновения зависит от количества частиц в единице объема, т.е. от концентрации. Зависимость скорости простой или элементарной реакции от концентрации реагирующих веществ выражается законом действия масс:
Скорость реакции пропорциональна произведению молярных концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам.
Для реакции
аА + bB ® …
закон выражается уравнением
n = kCAa • CBb,
где СА и СВ – молярные концентрации реагирующих веществ А и В, моль/л;
a и b – стехиометрические коэффициенты в уравнении реакции;
k – коэффициент пропорциональности, называемый константой скорости.
Константа скорости реакции зависит от природы реагирующих веществ, температуры, присутствия катализатора, но не зависит от концентраций реагентов и численно равна скорости реакции при условии СА = СВ =1.
Если одно из реагирующих веществ находится в твердом состоянии, то реакция происходит на поверхности раздела и в уравнение закона действия масс концентрация твердого вещества не включается. Так, для реакции
aA(г) + bB(к) ® …
n=kСАа.
3. Температура
Зависимость скорости реакции от температуры описывается правилом Вант-Гоффа: при повышении температуры на каждые 10° скорость большинства химических реакций увеличивается в 2-4 раза:
|
|
|
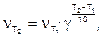 (6)
(6)
где 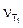 и
и 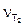 - скорости реакции при температурах Т1 и Т2.
- скорости реакции при температурах Т1 и Т2.
g - температурный коэффициент, значения которого для большинства реакций лежат в пределах 2-4.
Увеличение скорости реакции с повышением температуры объясняется увеличением числа активных молекул, т.е. молекул, обладающих достаточной энергией для осуществления химического взаимодействия при их столкновении. Та энергия, которой должны обладать соударяющиеся молекулы, чтобы между ними произошла реакция, называется энергией активации (Еа). Математическое соотношение между скоростью реакции, температурой и энергией активации называется уравнением Аррениуса:
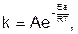 (7)
(7)
где k – константа скорости реакции;
R – газовая постоянная, Дж/моль•К;
Т – абсолютная температура, К;
Еа – энергия активации, кДж/моль;
е – основание натурального логарифма;
А – предэкспоненциальный множитель, не зависящий от температуры и концентрации.
Константа скорости тем больше, чем меньше Еа и чем выше температура.
Для расчетов используют уравнение Аррениуса, преобразованное для двух температур:
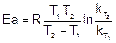 или
или 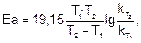
где 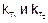 - константы скорости при температурах Т1 и Т2.
- константы скорости при температурах Т1 и Т2.
4. Поверхность соприкосновения реагентов.
В гетерогенных реакциях химическое взаимодействие происходит на поверхности раздела фаз. Увеличение площади поверхности твердого вещества путем его измельчения приводит к существенному ускорению реакции.
5. Катализатор.
Катализаторы – это вещества, увеличивающие скорость реакции. Катализатор образует с одним из реагентов промежуточное соединение, которое реагирует с другим исходным веществом, образуя продукты реакции и высвобождая катализатор. Ускоряющее действие катализатора, как правило, заключается в уменьшении энергии активации катализируемой реакции.
Пример 1. Как изменится скорость реакции
2NO(г) + О2(г) ® 2NO2(г),
когда прореагирует 55% кислорода, если начальные концентрации реагирующих веществ соответственно равны:
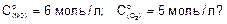
 2015-06-04
2015-06-04 1953
1953








