Валентность элемента. По квантово-механическим представлениям валентность элемента определяется числом неспаренных электронов в атоме элемента.
Валентные электроны могут принимать участие в образовании химических связей: для s- и р-элементов валентными являются электроны внешнего энергетического уровня, для d-семейства – электроны внешнего и предвнешнего энергетических уровней.
Например, валентными электронами в атоме селена считаются …4s24p4. В нормальном состоянии атома эти  распределены по соответствующим орбиталям следующим образом:
распределены по соответствующим орбиталям следующим образом:





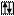
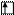
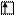
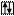 Se B=2
Se B=2
4s 4p 4d
По этой схеме неспаренных электронов два, следовательно, валентность селена в нормальном состоянии атома равна двум.
Если атому сообщить некоторое количество энергии, то атом перейдет в так называемое возбужденное состояние за счет перехода одного или нескольких из спаренных электронов в свободные орбитали данного энергетического уровня. Например,
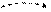 |




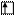
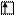
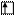
 Se* B*=4
Se* B*=4
4s 4p 4d
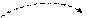 В этом энергетическом состоянии (…4s24p34d1) неспаренных электронов четыре, следовательно, валентность равна четырем.
В этом энергетическом состоянии (…4s24p34d1) неспаренных электронов четыре, следовательно, валентность равна четырем.
|
|
|



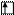
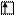
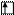
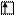
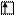 Se** B**=6
Se** B**=6
4s 4p 4d
В данном энергетическом состоянии (…4s14p34d2) шесть неспаренных  , следовательно, валентность селена равна шести.
, следовательно, валентность селена равна шести.
 Для элементов побочных подгрупп валентность атомов в нормальном состоянии равна нулю, т.к. внешние спаренные s-электроны как бы блокируют неспаренные d-электроны. Например, в атоме ванадия валентными
Для элементов побочных подгрупп валентность атомов в нормальном состоянии равна нулю, т.к. внешние спаренные s-электроны как бы блокируют неспаренные d-электроны. Например, в атоме ванадия валентными  считаются …3d34s2. В нормальном состоянии:
считаются …3d34s2. В нормальном состоянии:










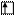
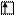 V B=0
V B=0
3d 4s 4p 4d
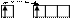 | |||||
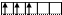 | |||||
 |
V* B*=5
3d 4s 4p 4d
Для элементов побочных подгрупп можно определить только максимальную валентность в возбужденном состоянии атома.
Степень окисления элемента. Степень окисления элемента часто совпадает по абсолютному значению с валентностью этого элемента в определенном энергетическом состоянии. Для элемента, имеющего переменную валентность, характерны и переменные степени окисления. Например, для хлора.
Внешний энергетический Валентность Степени окисления
уровень атома хлора хлора хлора





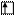
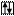
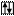
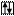 Cl B=1 -1; +1
Cl B=1 -1; +1
3s 3p 3d
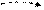 |




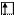
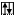
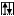
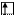
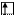 Cl* B*=3 +3
Cl* B*=3 +3
3s 3p 3d
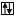 | 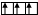 |  | |||
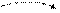 Cl** B**=5 +5
Cl** B**=5 +5
3s 3p 3d
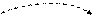


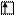
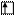
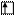
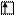
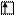 Cl*** B***=7 +7
Cl*** B***=7 +7
3s 3p 3d
Металлические свойства проявляют элементы, на высшем энергетическом уровне которых число  меньше номера внешнего энергетического уровня. Это все d- и f-элементы, s-элементы (кроме водорода и гелия), некоторые р-элементы.
меньше номера внешнего энергетического уровня. Это все d- и f-элементы, s-элементы (кроме водорода и гелия), некоторые р-элементы.
Неметаллические свойства проявляют элементы, у атомов которых на внешнем энергетическом уровне число  больше номера этого уровня.
больше номера этого уровня.
Если число  внешнего энергетического уровня совпадает с номером уровня, то свойства элемента промежуточные между свойствами металлов и неметаллов.
внешнего энергетического уровня совпадает с номером уровня, то свойства элемента промежуточные между свойствами металлов и неметаллов.
|
|
|
Свойства оксидов и гидроксидов. Кислотно-основные свойства оксидов и гидроксидов зависят от степени окисления элементов.
Оксиды металлов в низших степенях окисления (+1, +2) имеют основный характер. В качестве гидроксидов им соответствуют основания:
Основный оксид Гидроксид-основание
Na2O NaOH
MgO Mg(OH)2
MnO Mn(OH)2
Оксиды неметаллов и металлов со степенью окисления больше +4 имеют кислотный характер. В качестве гидроксидов кислотным оксидам соответствуют кислоты:
Кислотный оксид Гидроксид-кислота
SO3 H2SO4
N2O5 HNO3
Cl2O7 HClO4
CrO3 H2CrO4
Mn2O7 HMnO4
Оксиды металлов в степени окисления +3, +4 проявляют, как правило, амфотерные свойства. Амфотерными свойствами обладают также оксиды некоторых металлов в степени окисления +2: BеO, ZnO, PbO, SnO, CuO. В качестве гидроксидов амфотерным оксидам соответствуют и кислоты, и основания одновременно.
Кислота Амфотерный оксид Основание
H2ZnO2 ZnO Zn(OH)2
HAlO2 Al2O3 Al(OH)3
H2SnO3 SnO2 Sn(OH)4
Пример 1. Порядковый номер элемента равен 30. Укажите положение элемента в периодической системе: период, группу, подгруппу. Составьте электронную формулу атома элемента. Укажите электронное семейство, металл или неметалл. Составьте электронно-графическую формулу для валентных электронов в нормальном и возбужденном состояниях. Укажите возможные валентности и степени окисления атома. Составьте формулы высших и низших оксидов и соответствующих им гидроксидов.
Решение. В периодической системе элементов Д.И.Менделеева находим элемент с порядковым номером 30 – цинк: период – 4, группа – II, подгруппа – побочная. Заряд ядра составляет +30, число электронов – 30.
Электронная формула атома цинка:
1s22s22p63s24s23d10.
Цинк относится к d-семейству, т.к. последним заполняется d-подуровень. Число  на внешнем уровне (2) меньше номера внешнего уровня (4), следовательно, элемент – металл.
на внешнем уровне (2) меньше номера внешнего уровня (4), следовательно, элемент – металл.
Электронно-графическая формула для энергетического состояния атома …4s23d10
а) в нормальном состоянии








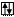
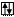
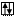
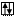
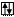
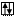 Zn B=0
Zn B=0
3d 4s 4p 4d
б) в возбужденном состоянии
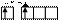 | |||||
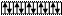 | |||||
 | |||||
Zn* B*=2
3d 4s 4p 4d
В соединениях цинк имеет степень окисления +2.
Оксид ZnO. Характер оксида амфотерный.
Гидроксид Zn(OH)2 и H2ZnO2.
Пример 2. Окончание электронной формулы …5s25p3. Укажите положение элемента в периодической системе: период, группу, подгруппу, назвать элемент. Составьте электронную формулу атома элемента. Укажите электронное семейство, металл или неметалл. Составьте электронно-графическую формулу для валентных  в нормальном и возбужденном состояниях. Укажите возможные валентности и степени окисления атома. Составьте формулы высших и низших оксидов и соответствующих им гидроксидов.
в нормальном и возбужденном состояниях. Укажите возможные валентности и степени окисления атома. Составьте формулы высших и низших оксидов и соответствующих им гидроксидов.
Решение. Так как внешний энергетический уровень атома пятый, элемент находится в пятом периоде. Общее число валентных  равно пяти, следовательно, элемент находится в пятой группе. Так как заполняется р-подуровень, то элемент расположен в главной подгруппе. В таблице элементов Д.И.Менделеева находим, что это элемент №51 – сурьма. Заряд ядра равен +51, общее число
равно пяти, следовательно, элемент находится в пятой группе. Так как заполняется р-подуровень, то элемент расположен в главной подгруппе. В таблице элементов Д.И.Менделеева находим, что это элемент №51 – сурьма. Заряд ядра равен +51, общее число  - 51. Сурьма относится к р-семейству, т.к. последним заполняется р-подуровень. Число
- 51. Сурьма относится к р-семейству, т.к. последним заполняется р-подуровень. Число  на внешнем энергетическом уровне (5) равно числу внешнего уровня (5), это значит, что сурьма может проявлять как металлические, так и неметаллические свойства.
на внешнем энергетическом уровне (5) равно числу внешнего уровня (5), это значит, что сурьма может проявлять как металлические, так и неметаллические свойства.
Электронная формула атома сурьмы:
1s22s22p63s23p64s23d104p65s24d105p3.
Электронно-графическая формула:
а) в нормальном состоянии




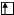
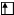
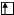
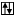
 Sb B=3
Sb B=3
5s 5p 5d
б) в возбужденном состоянии
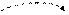
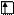

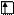



 Sb* B*=3
Sb* B*=3
5s 5p 5d
Степени окисления сурьмы в соединениях: +3, +5.
Оксид Sb2O3.
Характер оксида амфотерный.
Гидроксиды Sb(OH)3 и HSbO2.
Высший оксид Sb2O5.
Характер оксида кислотный.
|
|
|
Гидроксид HSbO3.
 2015-06-04
2015-06-04 1683
1683








