Температура замерзания раствора по сравнению с температурой замерзания растворителя понижается на Δt = tо ─ t градусов, tо – температура замерзания растворителя, t – температура замерзания раствора, Δt = К×Cm градусов; К – криоскопическая постоянная растворителя, [m] = моль/кг моляльность раствора
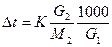 ;
; 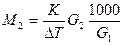 ; М2 - молярная масса растворенного вещества,
; М2 - молярная масса растворенного вещества,
G1(г) – масса растворителя G2(г) – масса растворенного вещества.
Если G1(г) масса растворителя; G2(г) масса растворенного вещества; тогда
масса раствора G0 = G1 + G2 = ρ×V и G2 = ρ×V×δ
Таблица 1.
| Растворитель | Эбулиоскопические постоянные | Криоскопические постоянные | ||
| Температура кипения, оК | ЕЭ[л×град/моль] | Температура замерзания, оК | КЗ [л×град/моль] | |
| Вода | 373,2 | 0,51 | 273,2 | 1,86 |
| Этиловый спирт | 351,7 | 1,21 | ||
| Бензол | 353,3 | 2,63 | 278,7 | 5,10 |
| Хлороформ | 334,4 | 3,76 | ||
| Нитробензол | 278,9 | 6,83 |
5.3 Осмотическое давление π = R×T×С (Уравнение Вант – Гоффа)
[C] = моль/ литр (молярная концентрация); 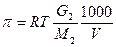 ;
;
R = 8,314, [π] = кПа Т = Т0К, G2(г) = масса растворенного вещества.
М – молярная масса растворенного вещества, V[мл] – объём раствора.
 2015-06-05
2015-06-05 483
483







