Из адсорбционного уравнения Гиббса (3.30) следует, что концентрирование вещества в поверхностном слое или переход его в объемную фазу определяется знаком производной d σ / dС.
Предельное значение этой производной при С→ 0, взятой со знаком «минус», называется поверхностной активностью (g):
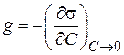 . (3.36)
. (3.36)
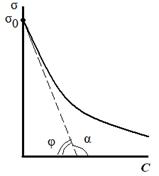 Рис. 3.24. Тангенсы угла наклона касательной
Рис. 3.24. Тангенсы угла наклона касательной
| Поверхностную активность рассчитывают как тангенс угла наклона касательной, проведенной к изотерме поверхностного натяжения исследуемого ПАВ при С→ 0, взятой с обратным знаком (рис. 3.24):
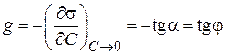 . .
| ||
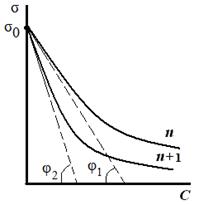 Рис. 3.25. Расчет поверхностной активности ПАВ
Рис. 3.25. Расчет поверхностной активности ПАВ
| Исследуя поверхностное натяжение водных растворов, Дюкло и Траубе установили зависимость между поверхностной активностью и числом атомов углерода.
Правило Дюкло – Траубе: при увеличении углеводородного радикала на группу –СН2–, поверхностная активность увеличивается в 3–3,5 раза (рис. 3.25):
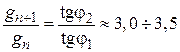 . (3.37) . (3.37)
| ||
Причина зависимости Дюкло – Траубе заключается в том, что
с увеличением длины углеводородной цепи уменьшается растворимость ПАВ и тем самым увеличивается стремление его молекул перейти из объема в поверхностный слой.
| 
|
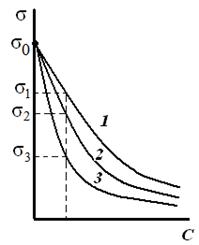
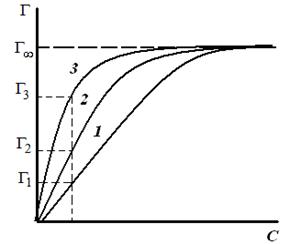
| Рис. 3.26. Изотермы поверхностного натяжения в растворах ПАВ | Рис. 3.27. Изотермы адсорбции в растворах ПАВ |
Таким образом, поверхностное натяжение раствора ПАВ уменьшается (σ1 > σ2 > σ3) по мере увеличения длины углеводородного радикала на группу –СН2– (рис. 3.26). При этом величины гиббсовской адсорбции будут возрастать (рис. 3.27) по мере увеличения длины углеводородного радикала в гомологическом ряду (Г1 < Г2 < Г3) и стремиться к одному и тому же предельному значению Г∞ («молекулярный частокол Лэнгмюра»).
Чем длиннее углеводородный радикал молекулы ПАВ, тем больше молекул в поверхностном слое, тем больше величина адсорбции.
 2015-06-05
2015-06-05 5095
5095
