БЕЛОРУССКИЙ НАЦИОНАЛЬНЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ
═══════════════════════════════════════
Кафедра химии
ЗАДАЧИ ЛАБОРАТОРНОГО
КОНТРОЛЯ ПО ХИМИИ
Учебно-методическое пособие по дисциплине «Химия»
Для студентов I курса
Под редакцией А.Р. Цыганова
М и н с к 2014
УДК 546.66.015
Авторы:
Г.А. Бурак, Г.К. Глушонок, В.А. Горбунова, Н.В. Зык, Н.Г. Кирюшина, Н.А. Кречко, Д.И. Медведев, А.А. Меженцев, И.Б. Проворова, Л.М. Слепнева, Ю.В. Шагойко, В.Н. Яглов
Задачи лабораторного контроля по химии / Учебно-методическое пособие по дисциплине «Химия» для студентов I курса. - Мн.: БНТУ, 2014
В данном пособии представлены решения типовых задач различного уровня сложности по основным разделам курса химии, который излагается студентам на лекциях. В задачах даны термины и условные обозначения, применяемые в Международной системе единиц.
Рецензент Я.Н. Ковалев
УДК 546.66.015
© Бурак Г.А. и др.
ВВЕДЕНИЕ
При изучении курса химии предусмотрены следующие виды занятий: лекции, практические и лабораторные занятия. Лекции читаются в соответствии с рабочей программой, вопросы которой представлены в приложении 2.
|
|
|
На первом занятии студент получает номер варианта своего индивидуального домашнего задания, которое он обязан выполнить к каждой лабораторной работе (см. приложение 1).
Домашнее задание включает краткий конспект по вопросам предстоящей лабораторной работы и задачи, соответствующие полученному студентом варианту.
Вопросы для конспектирования представлены в плане лабораторных работ, вывешенном в лаборатории.
Каждая лабораторная работа начинается с проверки домашнего задания. Затем проводится лабораторная работа.
Лабораторная работа считается зачтенной если:
а) студент выполнил домашнее задание (не менее 1 балла);
б) выполнил лабораторную работу с ошибкой менее 10%, оформил и сдал в установленное время отчет по лабораторной работе (2 балла);
в) защитил лабораторную работу. Защита лабораторной работы проводится путем решения задач ур. А (не менее 1 балла) и ур. В (до 4 баллов). Задачу ур. В студент может получить только, если задача ур. А решена не более, чем за 10 минут.
Преподаватель имеет право снижать оценку в случае некачественного выполнения и оформления отдельных видов работ. Суммарная минимальная оценка для получения зачета по лабораторной работе составляет 4 балла при условии хотя бы частичного выполнения всех трех слагаемых лабораторной работы: домашнего задания, лабораторной работы и ее защиты. При отсутствии оценки хотя бы по одному из этих трех слагаемых лабораторная работа не засчитывается.
|
|
|
Если студент не представил выполненное домашнее задание или не решил зачетную задачу или отчет по лабораторной работе, то защита этой лабораторной работы переносится на следующее занятие.
Если студент на следующем лабораторном занятии не представил выполненное домашнее задание по предыдущей работе или не представил отчет о предыдущей лабораторной работе, или не защитил предыдущую лабораторную работу, то эта лабораторная работа ему не засчитывается и студент обязан отработать ее полностью заново во вне учебное время в течение двух недель у своего преподавателя после оплаты в кассу университета. Оценка ставится только за зачтенную лабораторную работу. Если лабораторная работа не зачтена, то оценка - 0 баллов.
После выполнения лабораторной работы студенту выставляется оценка.
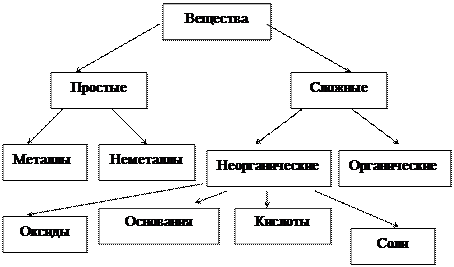
 1. ОСНОВНЫЕ КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
1. ОСНОВНЫЕ КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
|
 |  | ||
NO, CO, SiO, N2O
|
|
|
Основные:Кислотные:
Li2O - оксид лития; В2О3 - оксид бора;
MgO - оксид магния; СО2 - оксид углерода(IV);
МnО - оксид марганца(II). Mn2О7 - оксид марганца(VII)
FeO –оксид железа (II) CrO3 –оксид хрома (VI)
Амфотерные
BeO - оксид бериллия; ZnO - оксид цинка;
Al2O3 - оксид алюминия; SnO - оксид олова (II);
Cr2O3 - оксид хрома (III); PbO - оксид свинца (II).
СВОЙСТВА ОКСИДОВ:
Основные: CaO + СО2 = СаСO3 СuО + H2SO4 = CuSO4 + Н2О; Na2O +H2O=2NaOH; СuО + H2 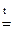 Cu + Н2О Cu + Н2О | Кислотные: СО2 + СuО = СuСO3 СО2 + NaOН = NaHCO3 СО2 + Ва(ОН)2 = = ВаСО3↓ + Н2О SO3 + Н2О = H2SO4; |
Амфотерные:
ZnO + 2HCl = ZnCl2 + H2O;
ZnO + 2 NaOH 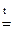 Na2ZnO2 + H2O;
Na2ZnO2 + H2O;
цинкат натрия
ZnO + 2 NaOH + H2O = Na2[Zn(OH)4];
тетрагидроксоцинкат натрия
Al2О3 + 6HCI = 2A1CI3 +3H2O;
А12О3 + Na2CO3 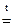 2NaAlO2 + CO2;
2NaAlO2 + CO2;
А12О3 + 2NaOH 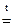 2NaAlO2 + H2O.
2NaAlO2 + H2O.
метаалюминат натрия
А12О3 + 2NaOH + 3 H2O = 2Na[Al(OH)4]
тетрагидроксоалюминат натрия

| LiOH - гидроксид лития; NaOH - гидроксид натрия; КОН - гидроксид калия; RbOH - гидроксид рубидия; CsOH - гидроксид цезия; Са(ОН)2 -гидроксид кальция; Sr(OH)2 - гидроксид стронция; Ва(ОН)2 - гидроксид бария; | Fe(OH)2- гидроксид железа (II); Mg(OH)2 - гидроксид магния Амфотерные гидроксиды: Zn(OH)2 = H2ZnO2 гидроксид цинковая цинка кислота А1(ОН)3 = Н3АlO3 = НАlO2 + Н2О гидроксид ортоалю- метаалю- алюминия миниевая миниевая кислота кислота |
СВОЙСТВА ОСНОВАНИЙ
Cu(OH)2 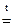 CuO + H2O.
CuO + H2O.
КОН +HCl = KCl + H2O;
Са(ОН)2 + CO2 = CaCO3↓ + H2O;
2NaOH + CuSO4 = Cu(OH)2↓ + Na2SO4;
Al(OH)3 + 3HCl = AlCl3 + 3H2O;
Al(OH)3 + NaOH 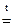 NaAlO2 + 2H2O;
NaAlO2 + 2H2O;
метаалюминат натрия
Al(OH)3 + 3NaOH 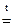 Na3AlO3 + 3H2O;
Na3AlO3 + 3H2O;
ортоалюминат натрия
Al(OH)3 + NaOH = Na[Al(OH)4];
тетрагидроксоалюминат натрия
Al(OH)3 + 3NaOH = Na3[Al(OH)6];
гексагидроксоалюминат натрия
|
 | |||
 | |||
| HF - фтороводородная HCl - хлороводородная; HJ - иодоводородная; НВг - бромоводородная; H2S - сероводородная; HCN - циановодородная. HSCN - родановодородная | H3BО3 - ортоборная; HBО2 - метаборная Н2СО3 - угольная; H4SiO4 - ортокремниевая, H2SiO3 - метакремниевая НNO3 - азотная; HNO2 - азотистая; Н3РО4 - ортофосфорная; НРО3 - метафосфорная; H2SO4 - серная; Н2SОз - сернистая; НМnО4 - марганцовая; НClO4 - хлорная; CH3COOH - уксусная; HCOOH –муравьиная |
СВОЙСТВА КИСЛОТ:
2НС1 + СаСO3 = СaCI2 + H2O + CO2↑;
2HC1 + Zn = ZnCI2 + H2↑;
H2SO4 + CuO = CuSO4 + H2O;
H2SO4 + Ba(OH)2 = BaSO4↓ + 2H2O;
H2SO4 + K2SiO3 = H2SiO3↓ + K2SO4;
HC1 + AgNO3 = AgCl↓ + HNO3.
H2 SiO3 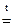 H2O + SiO2
H2O + SiO2
H2SO3 = H2O + SO2
 | |||
 | |||
| 2NaOH + H2SO4 = Na2SO4 + 2H2O; K2SO3 –сульфит калия; Na2SO4 - сульфат натрия; Ni(NO3)2 - нитрат никеля (II); Fe(NO2)3 – нитрит железо (III); K2S - сульфид калия; NH4Cl – хлорид аммония. Сa3(PO4)2 – ортофосфат кальция; КPO3 – метафосфат калия; Na2SiO3 – метасиликат натрия | Fe(OH)3 + 2HNO3 = = FeOH(NO3)2 + 2H2O (CuOH)2SO4 - сульфат гидроксомеди(II); Fe(OH)2NO3 – нитрат дигидроксожелеза (III); ZnOHСl – хлорид гидроксоцинка. |
|
 |
2H3РO4 + Ba(OH)2 = Ba(H2PO4)2 + 2H2O
KHSO3 - гидросульфит калия;
А1(Н2РО4)3 - дигидроортофосфат алюминия
Ca(HCO3)2 – гидрокарбонат кальция;
NaHS – гидросульфид натрия;
SrHPO4 – гидроортофосфат стронция.
Таблица 1.1. Кислоты и их соли.
| Формула кислоты | Формула аниона | Название аниона |
| HBO2 | BO2- | Метаборат |
| H3BO3 | BO33- | Ортоборат |
| Н2SO4 | SO42- | Сульфат |
| H2 SO3 | SO32- | Сульфит |
| HNO3 | NO3- | Нитрат |
| HNO2 | NO2- | Нитрит |
| H2CO3 | CO32- | Карбонат |
| H2SiO3 | SiO32- | Метасиликат |
| H3PO4 | PO43- | Ортофосфат |
| HPO3 | PO3- | Метафосфат |
| HMnO4 | MnO4- | Перманганат |
| HF | F- | Фторид |
| HСl | Cl- | Хлорид |
| HBr | Br- | Бромид |
| HI | I- | Иодид |
| H2S | S2- | Сульфид |
| HCN | CN- | Цианид |
| CH3COOH | CH3COO- | Ацетат |
| HCOOH | HCOO- | Формиат |
СВОЙСТВА СОЛЕЙ
|
|
|
Hg(NO3)2 + Zn = Zn(NO3)2 + Hg;
CuSO4 + 2 NaOH = Cu(OH)2↓ + Na2SO4;
Fe(NO3)2 + H2S = FeS↓ + 2HNO3;
CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl;
KHSO4+ KOH = K2S04 + H2O;
CuOHCl + HCl = CuCI2 + H2O;
CuSO4·5H2O 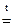 CuSO4 + 5H2O.
CuSO4 + 5H2O.
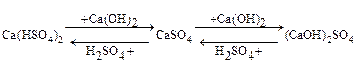
НЕКОТОРЫЕ ПРАВИЛА ОПРЕДЕЛЕНИЯ СТЕПЕНЕЙ ОКИСЛЕНИЯ ЭЛЕМЕНТОВ В ХИМИЧЕСКИХ СОЕДИНЕНИЯХ.
1. Степень окисления атомов в простых веществах равна нулю.
Например; Н2°; N2°, О2°, Na°, Cu°, Fe°, Hg°, Sо, P°, B° и др.
2. Атомы кислорода в основных классах неорганических соединений проявляют степень окисления (-2).
Например: Са+2О-2,S+4O2-2 и т.д.
Исключения: фторид кислорода О+2 F2-1 - степень окисления кислорода (+2), пероксиды - степень окисления кислорода (-1),
Например: Н2+1 О2-1, Ca+2 O2-1.
3. Атом водорода в основных классах неорганических соединений проявляет степень окисления (+ 1).
Например: H2+1S-2, N-3H3+1, Н2+1О-2, K+1O-2H+1, Na+1H+1C+4O 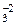 .
.
Исключения: гидриды металлов типа Ca+2H2-1; Na+1H-1; в которых степень окисления водорода (-1).
4. Металлы IA, IIА и IIIA главных подгрупп Периодической системы проявляют степень окисления равную номеру группы в которой находится этот элемент т.е. соответcтвенно (+1), (+2) и (+3) (см. табл.1.2).
Например: Na2+1O-2; Sr+2O-2; Al2+3O3-2.
5. Алгебраическая сумма степеней окисления отдельных атомов, образующих молекулу, с учетом их стехиометрических индексов равна нулю. Например, можно определить степень окисления азота в молекуле НNO3, зная степени окисления кислорода (-2) и водорода (+1): H+1NхО3-2
(+1) + х +(-2)·3 = 0; х = +5
или степень окисления хрома в молекуле К2+1Cr2хО7-2:
(+1) · 2 + х · 2 + (-2)·7 = 0 х = +6
6. Атомы одного и того же элемента в различных соединениях могут иметь разные степени окисления, например:
K+1Mn+7O4-2; H2+1Mn+6O4-2; Mn+4O2-2.
Таблица 1.2. Элементы, имеющие постоянную степень окисления в большинстве соединений
| I | II | III | IV | V | VI |
| H+ | |||||
| Li+1 | Be+2 | B+3 | O-2 | ||
| Na+1 | Mg+2 | Al+3 | |||
| K+1 | Ca+2 Zn+2 | Sc+3 | |||
| Rb+1 Ag+1 | Sr+2 Cd+2 | ||||
| Cs+1 | Ba+2 | ||||
| Fr+1 | Ra+2 |
|
|
|
 2015-06-05
2015-06-05 732
732