60 кДж/моль. Во сколько раз изменится скорость этой реакции:
а) при повышении температуры от 320 до 360К?
б) если она протекает при 298 К в присутствии катализатора (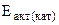 = 48 кДж/моль)?
= 48 кДж/моль)?

| РЕШЕНИЕ:
а) Из уравнения Аррениуса получаем:
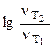 = = 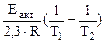
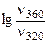 =
= =
= 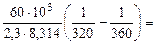 1,09 1,09
|
где 103 – коэффициент пересчета кДж в Дж, тогда
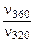 =101,09 = 12,3 раза;
=101,09 = 12,3 раза;
б) зависимость скорости реакции от наличия катализатора выражается уравнением:
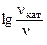 =
= 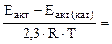
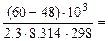 2,11
2,11
откуда 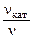 = 102,11 = 129.
= 102,11 = 129.
Ответ:
а) при повышении температуры от 320 до 360К скорость реакции возрастает в 12,3 раза;
б) в присутствии катализатора скорость реакции возрастает в 129 раз.
 2015-06-05
2015-06-05 4102
4102

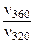 -?
б)
-?
б) 






