Пример 3.1. Расчет взаимной нейтрализации. Исходные данные: кислые сточные воды содержат H2SO4 – 4,7; HCl – 3,8 г/л; щелочные сточные воды содержат NaOH – 3,3; Na2CO3 – 2,9 г/л.
Решение. Для расчета взаимной нейтрализации концентрации кислот и щелочей надо выразить в граммах на литр.
В кислых сточных водах это составит
H2SO4 – 4,7: 49 = 0,0958 моль/л;
HCl – 3,8: 36,5 = 0,1041 моль/л;
итого кислот – 0,2 моль/л;
NaOH – 3,3: 40 = 0,0825 моль/л;
Na2CO3 – 2,9: 53 = 0,0547 моль/л;
итого щелочей – 0,1372 моль/л, где 49; 36,5; 40; 53 – эквиваленты H2SO4, HCl, NaOH и Na2CO3 соответственно.
В результате смешения равных объемов данных сточных вод преобладают кислые стоки: 0,2 – 0,1372 = 0,0628 моль/л щелочи. Это количество щелочи содержится в 0,46 л щелочной воды, что видно из следующего расчета: в 1 л содержится 0,1372 моль/л щелочи, а в X л содержится 0,0628 моль/л щелочи, тогда X = 0,0628: 0,1372 = 0,46 л щелочной воды.
Следовательно, для получения при взаимной нейтрализации воды со значением pH = 7 надо смешивать с 1 л кислой воды 1,46 л щелочной воды. Если для расчета взаимной нейтрализации известны значения pH, то пересчет концентрации производится по формулам:
для кислых стоков:
pH = – lg 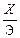 , (3.99)
, (3.99)
где X – концентрация кислоты, г/л; Э – ее эквивалентная масса;
для щелочных стоков
pH = 14 + lg 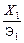 , (3.100)
, (3.100)
где X 1 – концентрация щелочи, г/л; Э1 – ее эквивалентная масса.
Пример 3.2. Расчет концентрации HNO3, имеющей значение pH = 2,02.
Решение. По формуле (3.99) произведен следующий расчет:
2,02 = – lg 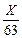 ; 2,02 = – (lg X – lg 63) = – lg X + lg 63,
; 2,02 = – (lg X – lg 63) = – lg X + lg 63,
где 63 – эквивалентная масса HNO3; lg 63 = 1,8, тогда
2,02 = – lg X + 1,8; lg X = 1,8 – 2,02 = – 0,22 = 1,78;
X (HNO3) = 0,603 г/л (0,603 антилогарифм 1,78).
Пример 3.3. Расчет концентрации NaOH (Х 1), имеющей значение pH = 12,77.
Решение. По формуле (3.100) произведем следующий расчет:
12,77 = 14 + lg 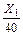 ; 12,77 = 14 + (lg X 1– lg 40),
; 12,77 = 14 + (lg X 1– lg 40),
где 40 – эквивалентная масса NaOH; lg 40 = 1,602; тогда
12,77 = 14 + lg X 1 – 1,602; lg X 1 = 12,77 – 14 + 1,602 = 0,372;
X 1 (NaOH) = 2,36 г/л (2,36 антилогарифм 0,372).
Непрерывно действующие фильтры, загруженные кусковым мелом, известняком, магнезитом, мрамором, доломитом и другими химическими веществами, могут применяться для нейтрализации солянокислых и азотнокислых сточных вод, а также сернокислотных, содержащих не более 5 г/л H2SO4 и не содержащих солей тяжелых металлов.
Если нейтрализуемая сточная вода содержит катионы металлов, то доза нейтрализующего реагента рассчитывается как на свободную кислоту, так и на концентрацию металлов. При достижении оптимального значения pH = 6,5…8,5 основное количество металлов выделяется в осадок в виде соответствующих гидроксидов.
Пример 3.4. Расчет количества образующегося осадка производится по формуле
М = 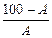 (A 1 + A 2) + A 3 + (E 1 + E 2 – 2), (3.101)
(A 1 + A 2) + A 3 + (E 1 + E 2 – 2), (3.101)
где А – содержание активной СаО в используемой извести, %; А 1 – количество активной СаО, необходимой для осаждения ме-таллов, кг/м3; А 2 – количество активной СаО, необходимой для нейтрализации свободной серной кислоты, кг/м3; А 3 – количес-тво образующихся гидроксидов металлов, кг/м3; Е 1 – количество сульфата кальция, образующегося при осаждении металлов, кг/м3; Е 2 – количество сульфата кальция, образующегося при нейтрализации свободной кислоты, кг/м3.
Третий член в данной формуле не учитывается, если его значение отрицательно.
Пример 3.5. Объем образующегося осадка рассчитывается по формуле
W mud = (10 ∙ M)/(100 – р mud), (3.102)
где р mud – влажность осадка, %.
Влажность осадка должна быть менее или равна разности 100 за вычетом количества сухого вещества, выраженного в процентах.
Пример 3.6. Расчет количества осадка, образующегося при нейтрализации кислых сточных вод, содержащих катионы металлов, производится по формулам (3.101) и (3.102).
Исходные данные. Нейтрализуемая сточная вода содержит 7 г/л FeSO4 и 10,3 г/л H2SO4. Применяемая для нейтрализации известь содержит 50 % активной CaO (A). Расход нейтрализуемой сточной воды qw = 120 м3/сут.
Определяем количество сухого вещества в осадке М по формуле (3.101). По реакции FeSO4 + CaO + H2O → CaSO4 + Fe(OH)2 находим значения А 1, А 2 и А 3 , г/л:
FeSO4 + CaO + H2O → CaSO4 + Fe(OH)2
152 56 136 90
7 А 1 А 2 А 3
A 1 = (7 ∙ 56) / 152 = 2,6; А 2 = (7 ∙ 136) / 152 = 6,2;
А 3 = (7 ∙ 90) / 152 = 4,1.
Затем по реакции H2SO4 + CaO → CaSO4 + H2O находим значения Е 1 и Е 2 , г/л:
H2SO4 + CaO → CaSO4 + H2O
98 56 136
10,3 Е 1 Е 2
Е 1 = (10,3 ∙ 56) / 98 = 5,9; Е 2 = 10,3 ∙ 136 / 98 = 14,3.
Найденные значения, г/м3, подставляются в формулу (3.94):
М = 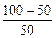 (2,6 + 6,2) + 4,1 + (5,9+14,3 – 2) = 31,1.
(2,6 + 6,2) + 4,1 + (5,9+14,3 – 2) = 31,1.
Определяем объем осадка, %, образующегося при нейтрализации 1 м3 сточной воды при влажности его 90 % по формуле (3.102):
W mud= (10 ∙ 31,1)/(100 – 90) = 3,1.
Общее количество влажного осадка, т/сут: 31,1 ∙ 120: 1000 = = 4,7.
Заметим, что влажность осадка всегда должна быть меньшей или равной 100 % минус количество сухого вещества. Если, например, количество сухого вещества М = 31,1 кг/м3, то влажность осадка не может быть более 96,9 %, а всегда равна или меньше этого значения.
Ориентировочное количество осадка, образующегося в зависимости от концентрации кислоты и ионов тяжелых металлов в нейтрализуемой воде и выделяющегося в накопителях, предназначенных для складирования его, может быть принята по следующим данным:
| Концентрация кислоты и ионов тяжелых металлов, кг/м3 | |||||||
| Количество осадков, м3, накапливаемых за 1 год от каждого 1 м3/сут нейтрализованной воды |
Пример 3.7. Требуется рассчитать установку для нейтрализации сточных вод металлургического завода при следующих исходных данных: расход сточных вод, включающих отработавшие травильные растворы, регенерация которых экономически нецелесообразна, промывные воды и смывы с полов, Q = 315 м3/сут; поступление стоков на нейтрализационную установку носит периодический характер, содержание серной кислоты в сточных водах А = 12 кг/м3, а сульфата железа С 1= 10 кг/м3; объем осадка 25 % от количества сточных вод; влажность осадка 86 %.
Решение. Ввиду неравномерного поступления производственных сточных вод металлургического завода предусматриваем приемный регулирующий резервуар вместимостью, равной количеству сточных вод за одну смену, т.е. 105 м3. Из приемного резервуара (рис. 3.14) сточные воды выпускаются равномерно q ст= 3,65 л/с.
При нейтрализации отработавших травильных растворов гашеной известью в виде известкового молока происходят следующие реакции:
с серной кислотой:
H2SO4 + CaO + H2O = CaSO4 · 2H2O;
98 56 18 136 36
с сульфатом железа:
FeSO4 + CaO + H2O = CaSO4 + Fe(OH)2.
152 56 18 136 90
На основании приведенных реакций и исходных данных о содержании свободной кислоты и связанного железа в сточных водах находим расход извести на нейтрализацию кислых сточных вод и осаждение железа по формуле (3.2).
Удельный расход негашеной извести на нейтрализацию серной кислоты определяем по табл. 3.2: а = 0,56, а по табл. 3.3 – расход негашеной извести, требуемой для перевода железа из растворенного состояния в осадок: b 1 = 1 (в пересчете на сульфат железа FeSO4 b 1 = 0,37). Для известкового молока K з= 1,1; В = 50 %, что составит, кг/сут:
G = 1,1 ∙ 315 (0,56 ∙ 12 + 0,37 ∙ 10) 100/50 = 7221.
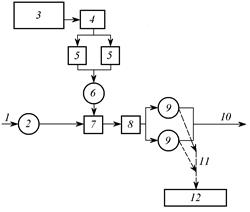
Рис. 3.14. Установка по нейтрализации отработавших травильных растворов:
1 – отработавшие травильные растворы; 2 – приемный резервуар; 3 – склад извести; 4 – помещение для гашения извести; 5 – растворные баки; 6 – дозатор; 7 – смеситель; 8 – камера нейтрализации; 9 – отстойники; 10 – нейтрализованный сток; 11 – осадок; 12 – шламовые площадки
Определим площадь закрытого склада для извести F, м2, исходя из необходимости хранения месячного запаса (t зап = 30 сут), высоты слоя извести при сухом способе хранения h из = 1,5 м и ее насыпной плотности ρ= 1 т/м3:
F = 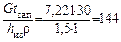 .
.
Принимаем размер склада 6×24 м.
Для гашения извести применяем механическую лопастную известегасилку марки С-322 производительностью 1 т/ч и устанавливаем ее в помещении рядом со складом извести. Известь приготовляют в виде известкового молока в растворных баках общей вместимостью, м3:
V p = 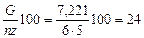 .
.
где n = 6 – число заготовок известкового молока в 1 сут; z – доля известкового молока в активной CaO, %; z = 5.
Принимаем два железобетонных бака прямоугольной формы, размером 3,5×3,5 м и глубиной наполнения 2 м; в баках устанавливаем лопастные мешалки с вертикальной осью и частотой вращения 40 мин-1. Известковое молоко из растворных баков подаем в дозатор. Расход известкового молока, л/с:
q из = (nV p ∙ 1000)/86400 = (6 ∙ 24)/86,4 = 1,67.
Общий расход нейтрализуемого отработавшего травильного раствора и известкового молока, л/с:
q общ = q ст+ q из = 3,65 + 1,67 = 5,32.
Нейтрализуемый раствор смешиваем с известковым молоком в смесителе; продолжительностью перемешивания t см равна 5 мин. Вместимость смесителя, м3:
V см = q общ ∙ 60 t см /1000 = 5,32 ∙ 60 ∙ 5/1000 = 1,6.
Смеситель принимаем круглым в плане со следующими размерами: D см = 1,5 м; H см = 1 м. В смесителе устанавливаем лопастную мешалку с частотой вращения 40 мин-1.
Из смесителя сточные воды подаются в проточную камеру нейтрализации, объем которой, м3, рассчитываем исходя из продолжительности нейтрализации t н = 30 мин:
V н = q общ ∙ 60 t н /1000 = 5,32 ∙ 60 ∙ 30/1000 = 9,6.
Принимаем размеры камеры нейтрализации 2,5×2,5 м, глубину 1,7 м; камеру нейтрализации оборудуем мешалкой с частотой вращения 40 мин-1.
После нейтрализации сточные воды подаются в отстойники вертикального типа с продолжительностью отстаивания не менее 2 ч. Приняв скорость восходящего потока v = 0,2 мм/с, определим площадь отстойника, м2:
F от = q общ / v = 5,32/0,2 = 26,6;
диаметр отстойника, м:
D от = 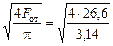 = 5,8.
= 5,8.
Высоту отстойной части отстойника h 1 принимаем равной 1,5 мм. Продолжительность пребывания сточных вод в отстойнике, ч:
t = h 1 /(v ∙ 3600) = 1500/(0,2 ∙ 3600) = 2,08.
Днище отстойника принимаем конусное с углом наклона к горизонту, равным 45о. Объем осадочной части V ос берем из расчета суточного хранения осадка. Объем осадка V ос составляет 25 % суточного расхода сточных вод и равен 79 м3. Осадок накапливается в цилиндрической части отстойника высотой h 3 = 1,8 м и в конической части отстойника высотой h 4 = 3 м. Общий объем осадочной части V ос = 80 м3.
Высоту нейтрального слоя в отстойнике h 2 принимаем 0,2 м.
Таким образом, общая высота отстойника, м:
H от = h 1 + h 2 + h 3 + h 4 = 1,5 + 0,2 + 1,8 + 3 = 7,5.
Принимаем два железобетонных отстойника диаметром 6 м каждый с кислотоупорной облицовкой. Отстойники попеременно выключаются для выгрузки осадка.
Пример 3.8. Рассчитать шламовые площадки для обезвоживания осадка от нейтрализационной установки промывных вод при следующих исходных данных: расход промывных вод Q = = 720 м3/сут; содержание серной кислоты в сточных водах А = = 0,5 кг/м3; содержание сульфата железа С 1 = 0,6 кг/м3; влажность осадка Р вл = 88 %.
Решение. Запишем уравнения реакций нейтрализации:
FeSO4 + CaO + H2O = CaSO4 + Fe(OH)2;
152 56 18 136 90
H2SO4 + CaO + H2O = CaSO4 + 2H2O.
98 56 18 136 36
Количество сухого вещества осадка, образующегося при нейтрализации 1 м3 промывных вод:
М = 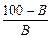 (x 1 + x 2) + x 3 + (y 1 + y 2 – 2),
(x 1 + x 2) + x 3 + (y 1 + y 2 – 2),
где В – содержание активной CaO в используемой извести, %: x 1, x 2 – количество активной CaO, необходимой соответственно для осаждения металлов и нейтрализации свободной серной кислоты, кг/м3; x 3 – количество образующихся гидроксидов металлов, кг/м3; y 1, y 2 – количество сульфата кальция, образующегося соответственно при осаждения металлов и нейтрализации свободной кислоты, кг/м3. Для нейтрализации промывных вод принимаем известь с содержанием активной CaO В = 70 %.
Вычисляем количество активной CaO, необходимой для осаждения железа и нейтрализации свободной серной кислоты, кг/м3:
x 1 = b 1 C 1 = 1 ∙ 0,37 ∙ 0,6 = 0,22;
x 2 = a A = 0,56 ∙ 0,5 = 0,28,
где b 1 в пересчете на сульфат железа определяем по табл. 3.3; a – по табл. 3.2.
Количество гидроксида железа, выделенного на 1 м3 воды, кг/м3, определяем по уравнению реакции осаждения сульфата железа:
x 2 = 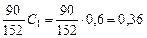 ,
,
а сульфата кальция, образующегося при осаждении металлов и нейтрализации свободной серной кислоты, кг/м3, – по уравнениям соответствующих реакций:
y 1 = 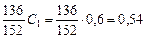 ;
;
y 2 = 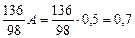 .
.
Поскольку значение третьего члена расчетной формулы отрицательное (y 1 + y 2 – 2) = (0,54 + 0,7 – 2) = – 0,76, то при подсчете сухого вещества, кг/м3, он не учитывается:
M = 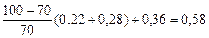 .
.
Доля осадка, образующегося при нейтрализации 1 м3 промывных вод:
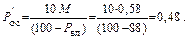
Общий объем осадка в сутки, м3:
P oc = 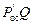 /100 = 0,48 · 720/100 = 3,5.
/100 = 0,48 · 720/100 = 3,5.
Шламовые площадки устраиваем в закрытом помещении и принимаем нагрузку на 1 м2 шламовой площадки q шл = 10 м3/год.
Общая площадь шламовых площадок, м2:
F шл = P oc ∙ 365/ q шл = 3,5 ∙ 365/10 = 128.
Принимаем четыре шламовые площадки размером 5×6,4 м и площадью 32 м2 каждая. Здание шламообезвоживающих площадок оборудуем грейферным краном для выгрузки осадка с площадок в автотранспорт.
Пример 3.9. Требуется рассчитать вертикальный фильтр для нейтрализации кислых сточных вод при следующих исходных данных: расход вод Q = 1200 м3/сут; концентрация серной кислоты A = 1,1 г/л; в сточных водах отсутствуют растворенные соли металлов.
Решение. В качестве загрузочного материала выбираем щелковский доломит (K з.м = 0,62) крупностью фракций d фр = 15 мм и плотностью ρ = 2,8 т/м3.
Высота слоя загрузочного материала, см:
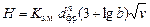 ,
,
где b – концентрация эквивалента кислоты, моль/л; v – скорость фильтрации, м/ч; n = 1,47 – константа.
Пересчитаем концентрацию эквивалента серной кислоты, моль/л:
b = 0,0204 A = 0,0204∙1,1=0,0225.
Скорость v назначаем равной 6 м/ч (обычно 4-8 м/ч). Тогда высота фильтра, см:
H = 0,62∙151,47(3 + lg 0,0225) 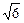 = 108.
= 108.
Площадь фильтрации, м2:
F = Q / v ’ = 0,014/0,0017 = 8,3,
где Q – расход нейтрализуемых сточных вод, м3/с; v ’ – скорость фильтрации, м/с.
Расход реагента, т/сут:
M = mAQ /1000 = 0,94 ∙ 1,1 ∙ 1200/1000 = 1,24,
где m – коэффициент, характеризующий стехиометрическое соотношение; в нашем случае m = 0,94.
Фактический расход доломита, т/сут:
M ф= 1,5 M = 1,5 ∙ 1,24 = 1,86.
Продолжительность работы фильтра без перегрузки, сут:
t = W / M ф = HF ρ/ M ф = 1,08 ∙ 8,3 ∙ 2,8/1,86 = 13,5,
где W – масса загруженного в фильтр нейтрализующего материала, т.
Таким образом, для нейтрализации сточных вод принимаем два круглых в плане вертикальных фильтра высотой 1,08 м и диаметром 2,3 м каждый.
Пример 3.10. Определить расход хлорной извести, необходимый для окисления цианидсодержащих сточных вод при следующих исходных данных: расход сточных вод Q = 300 м3/сут; концентрация простых цианидов в сточных водах C = 50 г/м3 (по цианид-иону CN-).
Решение. Для определения теоретического количества активного хлора x т, необходимого для окисления цианидов, запишем уравнение x т = nC, где n – теоретически необходимое количество активного хлора для окисления растворимого цианид-иона до цианат-иона по формуле
CN- + OСl- → CNO- + Cl-.
Активный хлор определяют по количеству молей иода, выделенных данным реагентом из иодистого калия в кислой среде.
При окислении простых цианидов и комплексных цианидов цинка n = 2,73, а при окислении комплексных цианидов меди n = = 2,96 и n = 3,18; расход хлорной извести, г/м3:
x т = 2,73 ∙ 50 = 136,5.
Расход хлорной извести, необходимой для окисления цианидсодержащих сточных вод, кг/сут:
x = Kз ∙ x т Q /(a ∙ 10) = 1,25 ∙ 136,5 ∙ 300/(30 ∙ 10) = 171,
где K з = 1,2…1,3 – коэффициент запаса реагента; a – содержание активного хлора в реагенте (в товарной хлорной извести 30-35 %).
Пример 3.11. Подобрать озонаторы для окисления производственных сточных вод при следующих исходных данных: расход сточных вод Q = 2300 м3/сут; требуемая доза озона для окисления загрязнений d оз = 18 г/м3.
Решение. Определим необходимый расход озона для окисления загрязнений, кг/сут, содержащихся в сточных водах:
D оз = d оз Q /1000 = 18 ∙ 2300/1000 = 41,4.
Подбираем озонаторы марки ОП-4, производительность которых 1 кг/ч по табл. 3.7. Число озонаторов:
m = 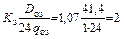 ,
,
где K з = 1,05…1,1; q оз – производительность одного озонатора, кг/сут.
Принимаем два рабочих и один резервный озонатор марки ОП-4.
Пример 3.12. Рассчитать контактную камеру барботажного типа для обесцвечивания и окисления загрязнений, содержащихся в сточных водах красильно-отделочной фабрики, перед их подачей в систему оборотного водоснабжения при следующих исходных данных: расход сточных вод Q = 3000 м3/сут; поступление сточных вод в контактную камеру равномерное; требуемая доза озона d оз = 21 г/м3; необходимое время контакта обрабатываемой сточной воды с озоновоздушной смесью t к = 25 мин.
Решение. Вычислим необходимый расход азота, кг/сут:
D оз = d оз Q /1000 = 21 · 3000/1000 = 63.
По табл. 3.8 подбираем озонаторы марки ОП-4, производительностью q оз = 1 кг/ч озона и концентрацией озона в озоно-воздушной смеси С оз = 20 г/м3.
Число рабочих озонаторов:
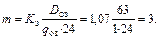
Принимаем контактные реакционные камеры барботажного типа с распыливающими элементами из керамических труб с порами размером d пор = 100 мкм и интенсивностью распыливания I p = 20 м3/(м2 · ч).
Общая площадь всех распыливающих элементов:
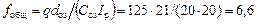 м2,
м2,
где q – расход обрабатываемых сточных вод, м3/ч.
Площадь распыливающего элемента f э = 0,144 м2 (диаметр d э = 0,092 м; длина l э = 0,5 м).
Общее количество распыливающих элементов n э и их общую длину ∑ l э , м, вычисляем по формулам
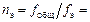 6,6 / 0,144 = 46;
6,6 / 0,144 = 46;
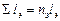 = 46 · 0,5 = 23.
= 46 · 0,5 = 23.
Принимаем четыре контактные реакционные камеры барботажного типа (рис. 3.15); керамические трубы располагаем по дну камеры на расстоянии 0,5 м между осями. Высоту слоя воды над распылителями принимаем Н = 4,5 м, а размер контактной камеры в плане 1,3×2,3 м. Распыливающие элементы собираем по два элемента в блоке с обеих сторон центрального коллектора; таким образом, конструктивно в каждой камере располагается по 12 распыливающих элементов.
Конструктивная вместимость контактных камер, м3:
V к = 4 · (1,3 · 2,3 · 4,5) = 54.
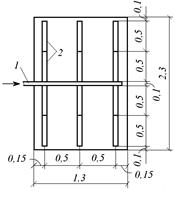 | Рис. 3.15. Расположение распыливающих керамических элементов в контактной камере барботажного типа: 1 – центральный коллектор озоновоздушной смеси; 2 – распыливающие элементы |
Необходимая вместимость камер с учетом продолжительности контакта обрабатываемой сточной воды с озоновоздушной смесью, м3:
V = K пр qt к = 1,1 · 125 · 25/60 = 57,2,
где K пр – коэффициент увеличения объема воды за счет продувки его озоновоздушной смесью, обычно равен 1,1; t к – продолжительность контакта, ч.
Поскольку конструктивный размер камер не обеспечивает необходимой продолжительности контакта, то окончательно принимаем размер камер в плане 1,3×2,3 м, а высоту слоя воды 4,8 м; в этом случае общая вместимость контактных камер барботажного типа составляет 57,4 м3. 
Задания для самоконтроля
1. Назовите способы нейтрализации при химической очистке сточных вод и дайте краткую характеристику их.
2. Приведите формулы для расчета количества реагентов для нейтрализации сточных вод, содержащих соли тяжелых металлов.
3. Приведите методику расчета фильтра-нейтрализатора.
4. Назовите хлорсодержащие вещества для окисления цианатов.
5. Назовите области существования продуктов гидролиза хлора в воде.
6. Приведите ряд последовательных стадий окисления гидросульфидной и сульфидной серы кислородом воздуха.
7. Назовите преимущества окисления веществ в сточных водах озоном.
8. Нарисуйте схему установки окисления сульфидов в сточных водах кислородом, нарисуйте устройство озонаторов.
9. Приведите конструкции контактных аппаратов для озонирования.
10. Назовите типы мешалок и области их применения.
11. Напишите формулу для определения центробежного критерия Рейнольдса.
12. Напишите формулу для определения мощности на перемешивание в реакторе с мешалкой.
 2015-06-10
2015-06-10 12744
12744
