Процессы электрохимического окисления и восстановления находят широкое применение в технологии очистки сточных вод. При этом происходит деструкция органических загрязнителей.
В качестве анодов используют следующие электрохимически нерастворимые материалы: графит (С), магнетит (Fe3O4), свинец и его соединения (Pb, PbO2), кремниевые сплавы и др. Катоды изготавливают из графита, молибдена, сплава вольфрама с железом или никелем, нержавеющей стали и ряда других веществ.
Рассмотрим наиболее распространенные примеры использования метода анодного окисления.
Электрохимическая очистка сточных вод от цианидов заключается в их обработке в открытых бездиафрагменных электролизерах непрерывного или периодического действия. Используются графитированные аноды, либо аноды из магнетита и диоксида свинца (на титановой основе). Катоды изготовлены из легированной стали.
Указанным методом обрабатываются сточные воды и растворы различных производств, содержащие цианиды и в первую очередь стоки гальванических цехов и участков, причем данный способ наиболее экономичен при концентрации цианидов ≥ 200 мг/л.
При электролизе щелочных сточных вод (обычно их рН лежит в пределах 8-12), содержащих цианистые соединения, происходит анодное окисление CN- ионов, а также комплексных анионов, содержащих CN--группы ([Cu(CN)3]2-, [Zn(CN)4]2-, [Cd(CN)4]2- и др.) с образованием цианат-ионов:
CN- + 2OH- – 2e- → CNO- + H2O, (5.1)
[Cu(CN)3]2- +6OH- – 6e- → Cu+ + 3CNO- + 3H2O. (5.2)
Образующиеся по реакциям (5.1) и (5.2) цианат-ионы (CNO-) частично окисляются на аноде с образованием нетоксичных газообразных продуктов:
2CNO- + 4OH- – 6e- → CO2↑ + N2↑ + 2H2O. (5.3)
На катоде происходит разряд Н+-ионов с образованием газообразного водорода, а также разряд ионов Cu+, Zn2+, Cd2+, образующихся при диссоциации комплексных ионов, содержащих CN--группы [Cu(CN)3]2-, [Zn(CN)4]2- и др.
Электролиз сточных вод проводят при анодной плотности тока 0,5-2 А/дм2. К сточным водам добавляют хлорид натрия в концентрации 5-10 г/л. При этом цианиды дополнительно окисляются хлором, выделяющимся на аноде вледствие электрохимического разложения хлористого натрия:
2Cl- – 2e- → Cl2 , (5.4)
Cl2 + CN- + 2OH- → CNO- + 2Cl- + H2O. (5.5)
Степень очистки сточных вод от цианидов приближается к 100 %. Кроме того, утилизируется до 80 % общего количества металлов, выделяемых в виде катодных осадков. Остальные 20 % от общего количества металлов удаляется в виде гидроксидов; рН процесса рекомендуется поддерживать в пределах 8-9 (рис. 5.2).
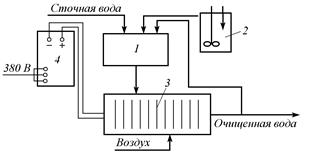
Рис. 5.2. Схема установки для электрохимического окисления цианидов:
1 – усреднитель; 2 – бак для приготовления раствора хлорида натрия; 3 – электролизер; 4 – выпрямитель переменного тока
При анодном окислении роданиды разрушаются по следующей схеме:
CNS- + 10OH- – 8e- → CNO- + 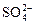 + 5H2O. (5.6)
+ 5H2O. (5.6)
Реакция анодного окисления органического соединения (формальдегида) протекает по схеме
НСНО + О → CO2 + H2 2e-. (5.7)
Рассмотрим примеры катодного восстановления металлов. Их используют для выделения из сточных вод следующих ионов тяжелых металлов: Pb2+, Sn2+, Hg2+, Cu2+ и др. Общая схема восстановления ионов металлов на катоде описывается реакцией
Mez+ · x H2O + ze- → [Me] + x H2O. (5.8)
Укажем, что очистку сточных вод от ионов Hg2+, Pb2+, Cd2+, Cu2+ проводят в кислой среде на катодах из смеси угольного и сернистого порошков при плотности тока 2,5 А/дм2. Рассмотренные катионы осаждают в виде сульфидов и бисульфидов.
Рассмотрим также реакцию электрохимической очистки сточных вод от NH4NO3. При проведении электролиза используют графитовый катод, на котором протекает следующая реакция:
NH4NO3 + 2Н+ + 2e- → NH4NO2 + Н2O. (5.9)
Нитрит аммония при нагревании разлагается с выделением азота:
NH4NO2 → N2↑ + 2Н2O. (5.10)
 2015-06-10
2015-06-10 1053
1053








