Как уже отмечалось выше, что в зависимости от ориентации спинов электронов в молекулярной орбитали, возможны два состояния молекулы водорода H2, которые описываются симметричной и антисимметричной волновыми функциями y s и y a соответственно. При этом оказывается, что возможны два значения энергии Es и Ea:
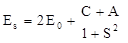 2.3
2.3
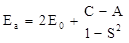 , 2.4
, 2.4
где E0 – энергия атома водорода в основном состоянии; A – обменная энергия (обменный интеграл); C – кулоновская энергия (кулоновский интеграл), т.е. энергия взаимодействия электронов с протонами; S – интеграл перекрытия. Величины A,C и S являются функциями расстояния между ядрами.
На рис.4 представлены рассчитанные по формулам (2.3) и (2.4) зависимости энергий Es и Ea от межъядерного расстояния для симметричного и антисимметричного состояний.
 На нем верхняя кривая изображает зависимость энергии молекулы от R – расстояния между протонами в состоянии, описываемом антисимметричной волновой функцией ya (два электрона с параллельными спинами); Как видно из рисунка, в этом случае связь не возникает. Нижняя кривая изображает Es = f(R) в состоянии с симметричной волновой функцией ys (спины у электронов антипараллельны). Она при R0 = 0,86 Å имеет минимум (экспериментальное значение R0 = 0,74 Å). То есть в состоянии ys возникает связь, причем расчет для энергии связи Ec дает значение Ec =3,14 эВ (экспериментальное значение Ec = 4,72 эВ). Обе потенциальные кривые обладают рядом общих свойств. При небольших расстояниях R между атомами потенциальные кривые стремятся к бесконечности при R® 0 (при R® 0 между атомами действуют силы отталкивания, превосходящие все остальные). Если R велико (R® ¥), то обе кривые асимптотически приближаются к значению 2E0, поскольку на больших расстояниях взаимодействие атомов исчезает, и энергия равна сумме энергий изолированных атомов.
На нем верхняя кривая изображает зависимость энергии молекулы от R – расстояния между протонами в состоянии, описываемом антисимметричной волновой функцией ya (два электрона с параллельными спинами); Как видно из рисунка, в этом случае связь не возникает. Нижняя кривая изображает Es = f(R) в состоянии с симметричной волновой функцией ys (спины у электронов антипараллельны). Она при R0 = 0,86 Å имеет минимум (экспериментальное значение R0 = 0,74 Å). То есть в состоянии ys возникает связь, причем расчет для энергии связи Ec дает значение Ec =3,14 эВ (экспериментальное значение Ec = 4,72 эВ). Обе потенциальные кривые обладают рядом общих свойств. При небольших расстояниях R между атомами потенциальные кривые стремятся к бесконечности при R® 0 (при R® 0 между атомами действуют силы отталкивания, превосходящие все остальные). Если R велико (R® ¥), то обе кривые асимптотически приближаются к значению 2E0, поскольку на больших расстояниях взаимодействие атомов исчезает, и энергия равна сумме энергий изолированных атомов.
Если рассматривать молекулы состоящие из более сложных атомов, у которых кроме внешней незаполненной электронной оболочки имеются еще и внутренние заполненные оболочки, то в этом случае электронные потенциальные кривые для таких молекул отличаются от кривых для молекулы водорода H2 тем, что при R® 0 эти кривые более круче стремятся к бесконечности. Это объясняется тем, что при тесном сближении атомов происходит перекрытие волновых функций электронов расположенных во внутренних оболочках. Но, поскольку все внутренние оболочки у обоих атомов заполнены, то такое перекрытие, как известно, приводит к образованию разрыхляющих молекулярных орбиталей, т.е. к появлению сил отталкивания между атомами, которые быстро возрастают с уменьшением расстояния R между атомами.
В заключение следует отметить, что молекулы могут иметь кроме основного электронного состояния и возбужденные электронные состояния. Электронные возбуждения молекулы приводят к изменению ее размеров, а часто и ее формы, т.к. при возбуждении один или оба электрона (по одному от каждого атома) переходят с низшей оболочки на одну из верхних. При этом каждому электронному состоянию соответствует своя потенциальная кривая, которая расположена тем выше, чем больше энергия возбуждения. Экспериментальные данные дают для молекул электронные энергии возбуждения порядка нескольких электронвольт.
 2015-06-28
2015-06-28 2216
2216
