Термодинамика — это наука о тепловых явлениях. В противоположность молекулярно-кинетической теории, которая делает выводы на основе представлений о молекулярном строении вещества, термодинамика исходит из наиболее общих закономерностей тепловых процессов и свойств макроскопических систем. Выводы термодинамики опираются на совокупность опытных фактов и не зависят от наших знаний о внутреннем устройстве вещества, хотя в целом ряде случаев термодинамика использует молекулярно-кинетические модели для иллюстрации своих выводов.
Термодинамическая система — это совокупность тел, способных обмениваться энергией между собой и с другими системами. Замкнутая термодинамическая система не обменивается энергией с другими системами
Термодинамическое равновесие — это состояние, при котором параметры системы имеют определенные, не меняющиеся со временем значения
Внутренняя энергия (U) может изменяться только под влиянием внешних воздействий, то есть в результате сообщения системе количества теплоты Q и совершения над ней работы (–А):
U2 – U1 = Q + (–A)
Q = A + ΔU — это математическая формулировка первого закона термодинамики:
Количество тепла, сообщенное системе, идет на приращение внутренней энергии системы и на совершение системой работы над внешними телами.
Уравнение dU = Q – A называется первым законом термодинамики.
Изменение внутренней энергии термодинамической системы dU равно разности полученного количества теплоты Q и работы A, совершенной системой.
Первый закон термодинамики является законом сохранения энергии для тепловых процессов.
Вечный двигатель первого рода не возможен – таков вывод из первого закона термодинамики.
Применим первое начало термодинамики для получения выражений для теплоемкости идеального газа.
Теплоемкость системы численно равна количеству теплоты, которое необходимо сообщить системе, чтобы ее температура увеличилась на 1 Кельвин.
Если система получила количество тепла dQ, и ее температура изменилась на dT, то теплоемкость (С) этой системы будет равна:
C = dQ / dT.
При механической обработке деталей (например, при сверлении) они нагреваются. Это означает, что изменяется их внутренняя энергия. Другим примером может служить опыт Джоуля (1843 г.) по определению механического эквивалента теплоты (рис.1). При вращении вертушки, погруженной в жидкость, внешние силы совершают положительную работу (A > 0); при этом жидкость из-за наличия сил внутреннего трения нагревается, то есть увеличивается ее внутренняя энергия. В этих двух примерах процессы не могут быть проведены в противоположном направлении. Такие процессы называются необратимыми.
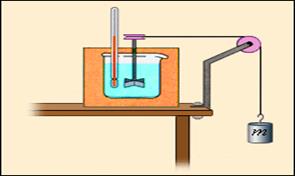
Рис. 1
На рисунке 2 изображены энергетические потоки между выделенной термодинамической системой и окружающими телами. Величина Q > 0, если тепловой поток направлен в сторону термодинамической системы. Величина A > 0, если система совершает положительную работу над окружающими телами.
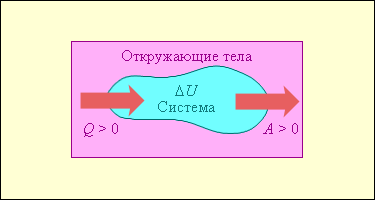
Рис.2
Меру изменения внутренней энергии при теплообмене называют количеством теплоты (Q). Теплота передаётся от более нагретого тела к менее нагретому.
Теплоту можно определить через умножение удельной теплоёмкости (C) на массу (m) и на разность температур (ΔT).
Q = C m ΔT
Теплоёмкость единицы количества вещества называется удельной теплоёмкостью.
Различают три вида удельной теплоёмкости:
С (КДж / кг К) — массовая (читается Ц)
С’ (КДж / м3 К) — объёмная (читается Ц со штрихом)
μС (КДж / моль К) — мольная (читается мю Ц)
В термодинамике принято удельную теплоёмкость называть просто теплоёмкостью.
Теплоёмкость газов с повышением температуры увеличивается.
Если 1 кг газа нагревается от t1oС до t2oC с подводом теплоты (q, КДж), то средняя теплоёмкость определяется из формулы:
С = q / (t2 – t1)
Количество теплоты определяется в изобарном (Р=const) и в изохорном (V=const) процессах, поэтому в уравнении определения количества теплоты (Q) ставятся индексы того уравнения, в котором происходит процесс.
Соответственно у теплоёмкостей тоже ставятся индексы, того же процесса, в котором определяется теплота.
Например, в изобарном процессе (Р=const):
Qр = Срm ΔТ; Qр = С’р Vну ΔТ
Ср — массовая теплоёмкость при постоянном давлении
(читается Ц–П или Ц с индексом П),
С’p — объёмная теплоёмкость при постоянном давлении
(читается Ц со штрихом П или Ц штрих П),
μСр — мольная теплоёмкость при постоянном давлении
(читается мю–Ц–П).
В изохорном процессе (V=const):
Qv = Сv m ΔТ; Qv = С’v Vну ΔТ
Сv — массовая теплоёмкость при постоянном объёме
(читается Ц–В или Ц с индексом В),
C’v — объёмная теплоёмкость при постоянном объёме
(читается Ц штрих В),
μСv — мольная теплоёмкость при постоянном объёме
(читается мю–Ц–В).
Если количество теплоты определяется через объёмную теплоёмкость — (С’р) или (С’v), то вместо массы в формулу ставится Vну — объём при нормальных условиях.
Нормальные физические условия соответствуют:
Р = 101325 Н / м2 =760 мм рт. ст.; tн = 0oC и Vμ = 22,4м3 / кмоль
Vμ — объём моля газа;
μ — молекулярная масса
R — газовая постоянная для каждого газа, а если её умножить на μ, то
μR — это универсальная газовая постоянная, имеющая одинаковое значение для всех газов, а именно: 8314,3 Дж / (кмоль К) или 8,3143 КДж / (кмоль К). А чтобы определить R, надо универсальную газовую постоянную разделить на молекулярную массу того газа, параметры которого определяются:
R = μR / μ (Дж / кг К) или (КДж / кг К)
R и μ можно взять из таблицы №1.
Таблица №1
| Газы | Химическое обозначение | Молекулярная масса — μ | Газовая постоянная — R, Дж / кг К |
| Азот | N2 | 28,013 | 296,015 |
| Аммиак | NH3 | 17,030 | 488,215 |
| Аргон | Ar | 39,948 | 208,128 |
| Воздух | — | 28,950 | 287,195 |
| Водород | H2 | 2,014 | 4128,252 |
| Водяной пар | H2O | 18,015 | 461,512 |
| Гелий | He | 4,0026 | 2077,224 |
| Кислород | O2 | 31,999 | 259,829 |
| Метан | CH4 | 16,043 | 518,251 |
| Окись углерода | CO | 28,0105 | 296,827 |
| Углекислый газ | CO2 | 44,010 | 188,918 |
Немецкий учёный Ю.Майер вывел уравнение, которое называется его именем. Уравнение Майера:
Ср – Сv = R
R — это газовая постоянная, которая имеет своё значение для каждого газа и выбирается из таблицы № 1.
Ср и Сv — можно определять из их мольных теплоёмкостей — μСр и μСv:
Ср = μCр / µ
Сv = μCv / μ
μСv определяем из уравнения Майера, если каждый из его членов умножим на μ, получаем: μСр – μСv =μ R ® μСv = μCр – μR
μR — универсальная газовая постоянная (равная всегда 8,3143 КДж / кмоль К) или 8314,3 Дж / кмоль К.
μCр для некоторых газов приведены в таблице №2.
Таблица №2
| Газы | μСp, КДж / кмоль К при Р = const |
| N2 | 28,5372 |
| O2 | 29,5802 |
| H2 | 28,3446 |
| CO | 28,7305 |
| CO2 | 41,3597 |
| SO2 | 42,8728 |
| Воздух | 28,7558 |
| H2O (пар) | 32,8367 |
Здесь надо обратить внимание на температуру.
Температура характеризует тепловое состояние тела и измеряется в градусах. Численное значение температуры зависит от принятой температурной шкалы.
Используются следующие температурные шкалы:
— абсолютная или термодинамическая — Т, К; (по шкале Кельвина);
— Цельсия или стоградусная (относительная), называемая также международной практической шкалой, — t, оС; (по шкале Цельсия);
— шкала Фаренгейта — t, oF и другие.
Абсолютная температура тела определяется:
Т, К = t, оС + 273,15
Шкала термометра зависит от термометрического вещества, так как разные тела при нагревании расширяются по-разному.
Для практических целей термометры градуируют по точкам плавления или кипения, при постоянной температуре.
Наиболее распространена стоградусная шкала, предложенная шведским физиком Цельсием. По ней лёд плавится при 00, вода кипит при 1000, а расстояние между ними делится на сто частей, каждая из которых считается градусом.
В Англии и США используют шкалу Фаренгейта, по ней температура плавления льда равна 320, а температура кипения воды равна 2120.
Во Франции используется шкала Реомюра, где температура плавления льда равна 00, температура кипения воды — 800.
Английский физик Томсон вывел абсолютную температуру, где шкала термометра не зависит от термометрического тела. Надо только произвольно задать одну точку, одно численное значение температуры.
По шкале Кельвина температура плавления льда — 273 К, то есть 00 С соответствует 273 К, поэтому Т, К = t, 0С + 273.
 2015-06-28
2015-06-28 5538
5538
