Изучение спектра излучения атомарного водорода
Методические указания
К выполнению лабораторной работы
ЕТИ.Ф. 03
Егорьевск 2003
Составитель: ст. преп. Никифоров В.Ю.
Рецензент доцент к.ф-м.н. Бурмистров А.В.
В методических указаниях рассмотрены: развитие представлений о строении атома, модели строения атома: модель Томпсона и планетарная модель Резерфорда, постулаты Бора, знакомство с квантовой моделью атома при моделировании процесса испускания электромагнитного излучения возбужденными атомами водорода, экспериментальное подтверждение закономерностей формирования линейчатого спектра излучения атомарного водорода при низких давлениях и экспериментальное определение постоянной Ридберга с использованием компьютерных моделей программы ООО «Физикон» «Открытая физика 1.1» версия «Виртуальный практикум по физике для ВУЗов». В основе данных методических указаний лежит учебное пособие «Тихомиров Ю.В. Лабораторные работы по курсу физики с компьютерными моделями (Квантовая физика). Учебное пособие для студентов высших технических учебных заведений дневной, вечерней и заочной (дистанционной) форм обучения. -М.:2003.-22 с.» Методические указания предназначены для студентов 2 вузовского курса, обучающихся по специальностям 120100, 120200, 330200,210200.
|
|
|
Методические указания обсуждены на заседании кафедры естественно-научных дисциплин.
Протокол № от
Заведующий кафедрой А.П. Нилов
Методические указания рассмотрены и одобрены методическим советом института
Протокол № от
Председатель совета А.Д.Семенов
Изучение спектра излучения атомарного водорода
1 Цель работы Знакомство с планетарной и квантовой моделями атома при моделировании процесса испускания электромагнитного излучения возбужденными атомами водорода.
Экспериментальное подтверждение закономерностей формирования линейчатого спектра излучения атомарного водорода при низких давлениях.
Экспериментальное определение постоянной Ридберга.
2 Оборудование: компьютерный класс, пакет прикладных программ для поддержки лабораторного практикума компании ООО «ФИЗИКОН» «Виртуальный практикум для ВУЗов».
3 Содержание работы
3.1 Изучение теоретического материала, с использованием конспекта лекций и учебника.
3.2 Запуск программы: выбрать «Квантовая физика» и «Постулаты Бора». Ознакомление с краткими теоретическими сведениями программы. Запись необходимого в конспект.
3.3 Отметить маркером мыши уровень энергии электрона с номером n0, указанным в таблице 2 для вашей бригады.
3.4 Наблюдение и зарисовывание модели атома водорода (в левом верхнем поле), а также стрелок в правом поле и отметки в нижнем поле, соответствующих линиям в данной серии.
|
|
|
3.5 Запись в таблицу 1 величины главного квантового числа n0 для нижнего уровня энергии данной серии, названия серии и длины волн отдельных линий.
3.4 Вычисление и запись в таблицу 1 обратных длин волн.
3.5 Определите, переходу между какими квантовыми состояниями электрона в атоме водорода соответствует каждая линия излучения. Запись в таблицу значения n.
3.6 Построение графика зависимости обратной длины волны (1/l) от обратного квадрата главного квантового числа (1/n2) для данной спектральной серии.
3.7 Определение по наклону графика значение постоянной Ридберга 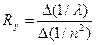
3.8 Оформление отчета.
4 Краткие теоретические сведения
4.1 Открытие сложного строения атома — важнейший этап становления современной физики, наложивший отпечаток на все ее дальнейшее развитие. В процессе создания количественной теории строения атома, позволившей объяснить атомные спектры, были открыты новые законы движения микрочастиц — законы квантовой механики.
Английский физик Эрнест Резерфорд исследовал рассеяние a-частиц веществом и открыл в 1911г. атомное ядро - массивное образование, в несколько тысяч раз меньшее по размеру, чем атом.
4.2 Модель Томсона. Не сразу ученые пришли к правильным представлениям о строении атома. Первая модель атома была предложена английским физиком Дж. Дж. Томсоном, открывшим электрон. По мысли Томсона, положительный заряд атома занимает весь объем атома и распределен в этом объеме с постоянной плотностью. Простейший атом - атом водорода — представляет собой положительно заряженный шар радиусом около 10-8 см, внутри которого находится электрон. У более сложных атомов в положительно заряженном шаре находится несколько электронов, так что атом подобен кексу, в котором роль изюминок играют электроны.
Однако модель атома Томсона оказалась в полном противоречии с опытами по исследованию распределения положительного заряда в атоме. Эти опыты, произведённые впервые Э. Резерфордом, сыграли решающую роль в понимании строения атома.
4.3 Опыты Резерфорда Масса электрона в несколько тысяч раз меньше массы атомов. Так как атом в целом нейтрален, то, следовательно, основная масса атома приходится на его положительно заряженную часть.
Для экспериментального исследования распределения положительного заряда, а значит, и массы внутри атома Резерфорд предложил в 1906 г. применить зондирование атома с помощью a-частиц. Эти частицы возникают при распаде радия и некоторых других элементов. Их масса примерно в 8000 раз больше массы электрона, а положительный заряд равен по модулю удвоенному заряду электрона. Это не что иное, как ионизированные атомы гелия. Скорость a-частиц очень велика:онасоставляет 1/15 скорости света.
Этими частицами Резерфорд бомбардировал атомы тяжелых элементов. Электроны вследствие своей малой массы не могут заметно изменить траекторию a-частицы, подобно тому как камушек в несколько десятков граммов при столкновении с автомобилемне в состоянии заметно изменить его скорость.
Рассеяние (изменение направления движения) a-частиц может вызвать только положительно заряженная часть атома. Таким образом, по рассеянию a-частиц можно определить характер распределения положительного заряда и массы внутри атома. Схема опытов Резерфорда показана на рисунке 1.
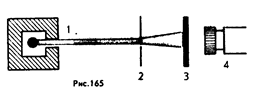
1 Свинцовый цилиндр с источником a-частиц
2 Тонкая фольга
3 Экран с люминофором
4 Микроскоп
Рисунок 1
Радиоактивный препарат, например радий, помещался внутрь свинцового цилиндра 1, вдоль которого был высверлен узкий канал. Пучок a-частиц из канала падал на тонкую фольгу 2 из исследуемого материала (Золото, медь и пр.). Послерассеяния a-частицы попадали на полупрозрачный экран 3, покрытый сульфидом цинка. Столкновение каждой частицы с экраном сопровождалось вспышкой света (сцинтилляцией), которую можно было наблюдать в микроскоп 4. Весь прибор размещался в сосуде, из которого был откачан воздух.
|
|
|
При хорошем вакууме внутри прибора в отсутствие фольги на экране возникал светлый кружок, состоящий из сцинтилляций, вызванных тонким пучком a-частиц. Но когда на пути пучка помещали фольгу, a-частицы из-за рассеяния распределялись на экране по кружку большей площади.
Модифицируя экспериментальную установку, Резерфорд попытался обнаружить отклонение a-частиц на большие углы. Совершенно неожиданно оказалось, что небольшое число a-частиц (примерно одна из двух тысяч) отклонилось на углы, большие 90°.
4.4 Определение размеров атомного ядра. Резерфорд понял, что a-частица могла быть отброшена назад лишь в том случае, если положительный заряд атома и его масса сконцентрированы в очень малой области пространства. Так Резерфорд пришел к идее атомного ядра — тела малых размеров, в котором, сконцентрированы почти вся масса и весь положительный заряд атома.
На рисунке 2,а показаны траектории a-частиц, пролетающих на различных расстояниях от ядра.
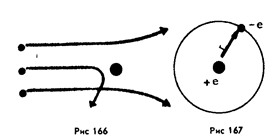
Рисунок 2 а) и б)
Подсчитывая число a-частицы, рассеянных на различные углы, Резерфорд смог оценить размеры ядра. Оказалось, что ядро имеет диаметр порядка 10-12—10-13 см (у разных ядер диаметры различны). Размер же самого атома 10-8 см, т.е. в 10—100 тыс. раз превышает размеры ядра. Впоследствии удалось определить и заряд ядра. При условии, что заряд электрона принят за единицу, заряд ядра в точности равен номеру данного химического элемента в периодической системе Д. И. Менделеева.
4.5 Планетарная модель атома. Из опытов Резерфорда непосредственно вытекает планетарная модель атома. В центре расположено положительно заряженное атомное ядро, в котором сосредоточена почти вся масса атома. В целом атом нейтрален. Поэтому число внутриатомных электронов, как и заряд ядра, равно порядковому номеру элемента в периодической системе. Ясно, что покоиться электроны внутри атома не могут, так как они упали бы на ядро. Они движутся вокруг ядра, подобно тому, как планеты обращаются вокруг Солнца. Такой характер движения электронов определяется действием кулоновских сил со стороны ядра.
|
|
|
В атоме водорода вокруг ядра обращается всего лишь один электрон. Ядро атома водорода имеет положительный заряд, равный по модулю заряду электрона, и массу, примерно в 1836,1 раза большую массы электрона. Это ядро было названо протоном и стало рассматриваться как элементарная частица. Размер атома — это радиус орбиты его электрона (рисунок 2 б).
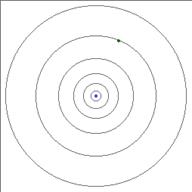
Рисунок 3 Планетарная модель атома
Простая и наглядная планетарная модель атома имеет прямое экспериментальное обоснование. Она кажется совершенно необходимой для объяснения опытов по рассеиванию a-частицы. Но на основе этой модели нельзя объяснить факт существования атома, его устойчивость. Ведь движение электронов по орбитам происходит с ускорением, причем весьма немалым. Ускоренно движущийся заряд по законам электродинамики Максвелла должен излучать электромагнитные волны с частотой, равной частоте его обращения вокруг ядра Излучение сопровождается потерей энергии. Теряя энергию, электроны должны приближаться к ядру, подобно тому, как спутник приближается к Земле при торможении в верхних слоях атмосферы. Как показывают строгие расчеты, основанные на механике Ньютона и электродинамике Максвелла, электрон за ничтожно малое время (порядка 10 8 с) должен упасть на ядро Атом должен прекратить свое существование.
В действительности ничего подобного не происходит. Атомы устойчивы и в невозбужденном состоянии могут существовать неограниченно долго, совершенно не излучая электромагнитные волны.
Не согласующийся с опытом вывод о неизбежной гибели атома вследствие потери энергии на излучение - это результат применения законов классической физики к явлениям, происходящим внутри атома. Отсюда следует, что к явлениям атомных масштабов законы классической физики неприменимы. Резерфорд создал планетарную модель атома: электроны обращаются вокруг ядра, подобно тому,какпланеты обращаются вокруг Солнца. Эта модель проста, обоснована экспериментально, но не позволяет объяснить устойчивость атомов.
4.6 Спектры. Виды спектров Спектром электромагнитного излучения (ЭМИ) называется совокупность электромагнитных волн, излучаемых или поглощаемых атомами (молекулами) данного вещества.
Все атомы химического элемента обладают одинаковым зарядом атомного ядра, их электронные оболочки имеют одинаковое строение. Поэтому набор частот испускаемых квантов или длин волн излучаемого света у всех атомов одного элемента одинаков.
У каждого химического элемента свой заряд атомного ядра и свое особое строение электронной оболочки. Возбужденные атомы каждого химического элемента испускают световые кванты таких частот, какие не испускают атомы ни одного другого химического элемента. Состав излучения по длинам волн можно узнать, пропустив узкий пучок света через стеклянную призму. Получающийся при разложении линейчатый спектр служит точным «паспортом», по которому можно узнать химический элемент.
Спектры испускания условно делятся на три типа:
а) Светящиеся твердые и жидкие (расплавленные) тела излучают комплексы лучей с постепенным переходом от волн одной длины к волнам другой длины, поэтому спектр их излучения имеет вид цветной полоски с непрерывно изменяющейся окраской, они содержат все длины волн в определенном диапазоне. Такие спектры называются сплошными.
б) Светящиеся атомарные пары и газы (пламя, газы в разрядных трубках) дают спектры прерывистые, или линейчатые, состоящие из отдельных цветных линий, получающиеся от лучей с разными длинами волн. Линейчатый спектр состоит из отдельных компонент (линий), близких к гармоническим. Расстояние между линиями (по шкале длин волн или частот) много больше ширины линий.
в) Полосатые спектры, состоят из совокупности нескольких полос испускания, разделенных промежутками; такие спектры характерны для разреженных молекулярных газов.
Всякое вещество способно поглощать часть проходящего через него излучения. Если через вещество пропускается свет с непрерывным спектром, то спектральный анализ прошедшего света показывает, что в исходно непрерывном спектре появляются отдельные темные линии (спектр поглощения). Спектры солнечного излучения основной массы Солнца имеет вид сплошного, но с большим числом темных тонких линий, пресекающих спектр, получающихся от излучения раскаленных паров и газов, окружающих в виде оболочки основную массу Солнца и поглощающих те лучи, которые они сами испускают. Так как яркость испускания газов солнечной оболочки гораздо меньше, чем яркость лучей основного ядра, то соответственные места спектра кажутся темными. Главные лучи поглощения солнечного спектра называются фраунгоферовыми и отмечаются буквами латинского алфавита.
Г. Кирхгоф установил, что атомы или молекулы данного вещества поглощают свет тех же длин волн, которые они сами могут испускать. Таким образом, положение ярких линий в спектре испускания данного вещества в точности соответствует положению темных линий в спектре поглощения этого же вещества.
Атомы или молекулы каждого вещества, как отмечалось выше, испускают спектр строго определенных частот, являющийся однозначной характеристикой самого вещества. Таким образом, спектральный анализ (т.е. изучение спектра испускания данного вещества) позволяет безошибочно определить химический состав вещества. Спектральный анализ имеет широчайшие применения в технике и других областях (например, криминалистике).
Важнейшую роль играют исследования спектров испускания далеких звезд, позволяющие установить химический состав верхних слоев звезды, распространенность тех или иных элементов, как в самих звездах, так и в межзвездном пространстве. Кроме того, сдвиг положения спектральных линий, связанный с эффектом Доплера, позволяет точно измерить скорость удаления или приближения к нам звезды или галактики, несмотря на колоссальные расстояния до этих объектов.
4.7 Модель Бора Описанная планетарная модель атома совершенно неприемлема с точки зрения законов классической физики. Дело в том, что, как вытекает из законов электродинамики Максвелла, любой ускоренно движущийся заряд излучает электромагнитные волны. Поэтому электрон, двигаясь с центростремительным ускорением υ2/r по орбите, постепенно должен терять энергию и неизбежно упасть на ядро. Можно подсчитать время жизни атома водорода до момента падения электрона на ядро. Оказывается, что атом просуществовал бы всего около 10-10 с.
В 1913 г. Н. Бор предложил теоретическое объяснение модели атома Резерфорда, основанное на отказе от ряда классических представлений, прежде всего, на отказе от утверждения о непрерывности классических величин типа энергии и момента импульса. Этим Бор заложил основы квантовой теории.
В дальнейшем полуклассическая и во многом непоследовательная модель Бора была заменена строгими законами квантовой механики.
4.8 Постулаты Бора:
1. Электрон в атоме водорода может находиться только на орбитах, для которых значение момента импульса электрона в единицах ħ= h/2π =1,0545·10-34 Дж·с равно целому числу:
L = mυrn = n(h/2π) =nħ, (1)
где L - момент импульса электрона, m - его масса, rn - радиус n-ой орбиты, h=6,626·10-34 Дж·с, n = 1, 2, 3,...
Соответственно энергия электрона на каждой из орбит имеет определенное значение En, а другие значения энергии невозможны.
2. Находясь на этих орбитах, электрон не излучает энергию.
3. Излучение энергии в виде электромагнитного излучения происходит только при переходе (скачке) электрона с одной орбиты (с большей энергией En) на другую (с меньшей энергией Em), причем энергия испущенного фотона
hν = En - Em. (2)
С помощью этих постулатов можно вычислить радиусы разрешенных орбит и энергию электрона на них для атома водорода. Используем два уравнения:
постулат Бора: mυrn=ħn; (3)
закон движения: mυ2/rn= ke2/rn2. (4)
Исключая υ из нижнего соотношения с помощью верхнего, получим:
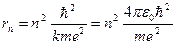 (5)
(5)
где ε0 =8,854·10-12 Ф м-1 - электрическая постоянная, е = 1,6022 10-19 Кл - заряд электрона, n=1, 2, 3,...
Пользуясь формулой, связывающей полную энергию с потенциальной, находим разрешенные значения энергии для атома водорода:
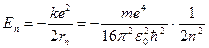 , где n=1, 2, 3,... (6)
, где n=1, 2, 3,... (6)
При n = 1 получаются наименьшее возможное значение радиуса орбиты a = r1 (боровский радиус) и наибольшее по абсолютной величине значение полной энергии электрона E1 = - ke2/(2a). Говорят, что в этом случае электрон находится в основном состоянии.
Численно a = 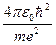
 = 0,53·10-10 м =0,053 нм; (7)
= 0,53·10-10 м =0,053 нм; (7)
Е1 = 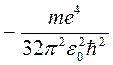 = - 2,17·10-18 Дж = - 13,6 эВ. (8)
= - 2,17·10-18 Дж = - 13,6 эВ. (8)
Здесь введена принятая в задачах атомной и ядерной физики единица измерения энергии - электрон-вольт (эВ) - равная работе по перемещению элементарного заряда е между точками с разностью потенциалов ΔU = 1 В:
1 эВ = eΔU = 1,6 10-19 Кл·1 В = 1,6·10-19Дж.
Пользуясь постулатом Бора, можно также вычислить импульс и скорость электрона на первой боровской орбите:
р1= ħ/a= 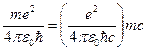 = αmc» mc/137=0,2×10-23 м/с (9)
= αmc» mc/137=0,2×10-23 м/с (9)
υ1= р1/m = αс» c/137=2,2×106 м/с. (10)
Здесь введена важная безразмерная фундаментальная постоянная, определяющая интенсивность электромагнитного взаимодействия:
α = 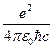 » 1/137 (11)
» 1/137 (11)
Она называется постоянной тонкой структуры.
Радиусы других орбит даются формулой:
rn = α·n2, n = 1, 2, 3,... (12)
Электрон может находиться в любом из состояний с энергией, которая определяется формулой:
En = E1/n2, n = 1, 2, 3,... (13)
Эти состояния называются стационарными состояниями. Находясь в стационарном состоянии, электрон не излучает энергию.
Излучение в форме фотонов - квантов света - происходит при переходе электрона из состояния с большим значением энергии Еn в любое из состояний с меньшим значением энергии Em. При таком переходе испускается фотон с энергией hν, определяемой по закону сохранения энергии:
hν = En - Em. (14)
Если перейти к длинам волн фотонов, используя соотношение ν=c/λ, то после подстановки значений энергии получим:
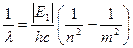 =
= 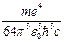
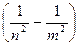 =
= 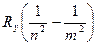 (15)
(15)
Введенная здесь постоянная Ry = 1,097·107 м-1 называется постоянной Ридберга.
Спектральные серии водорода, наблюдаемые на опыте, соответствуют переходам из возбужденных состояний с номерами m в конечные состояния с номерами n = 1, 2, 3,...:
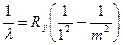 m= 2, 3, 4, ¼. (16)
m= 2, 3, 4, ¼. (16)
(серия Лаймана);
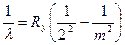 , m= 3, 4, 5, ¼. (17)
, m= 3, 4, 5, ¼. (17)
(серия Бальмера);
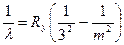 , m= 4, 5, 6,¼. (18)
, m= 4, 5, 6,¼. (18)
(серия Пашена) и т.д.
Следует отметить, что представление о движении электрона в атоме по законам классической механики по избранным (стационарным) орбитам имеет лишь историческое значение. Современная квантовая физика описывает состояние электрона в атоме с помощью так называемых волновых функций и отказывается от классических представлений о траекториях движения микрообъектов.
4.9 Серия Бальмера водорода Спектры испускания атомов могут быть экспериментально исследованы с помощью приборов, называемых спектроскопами или спектрографами. В простейшем спектроскопе свет проходит через щель и затем разлагается в спектр с помощью призмы. Система линз фокусирует изображение спектра либо для визуального наблюдения либо для записи на фотопластинке. Каждая длина волны света формирует изображение входной щели. Школьный спектроскоп (рисунок 4) состоит из двух труб – коллиматорной 1 и зрительной, укрепленных на подставке 2, стеклянной призмы 3 под крышкой и микрометрического винта 5. На одном конце коллиматорной трубы имеется щель для выделения узкого пучка света. На другом её конце – линза для превращения расходящегося пучка света в параллельный пучок. Параллельный пучок света,выходящий из коллиматорной трубы О, падает на грань стеклянной призмы. Коэффициент преломления света зависит от его длины волны, поэтому свет сложного состава разлагается призмой на несколько параллельных пучков и создает цветные изображения щели. (рисунок 5). Эти разноцветные изображения щели и являются линейчатым спектром химического элемента. Измерив длины волн линий полученного спектра и сравнив найденные значения с табличными сведениями о спектрах различных химических элементов, можно узнать, какому элементу принадлежит исследуемый спектр.
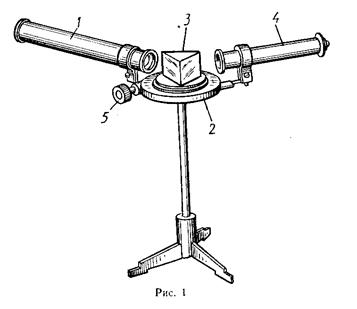
Рисунок 4 Школьный спектроскоп
.
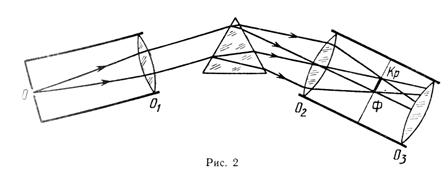
Рисунок 5 Ход лучей в спектроскопе
Для изучения химического состава вещества методом спектрального анализа исследуемое вещество нагревается до такой температуры, при которой оно находится в газообразном состоянии и излучает свет. Для возбуждения атомов вещества, находящегося в газообразном состоянии, часто используется электрический разряд.
Как уже было выше отмечено, спектры газов содержат серии спектральных линий. Каждая линия соответствует определенной длине волны света, испущенного атомами газа.
Происхождение линейчатых спектров можно объяснить на основе двух концепций. Первая из них - это представление о фотонах; вторая - это концепция энергетических уровней атома. Эти представления были объединены в квантовой теории атома, созданной датским физиком Нильсом Бором в 1913 г.
СПЕКТРАЛЬНОЙ СЕРИЕЙ называется совокупность линий излучения, соответствующих переходу электрона в атоме на один и тот же нижний уровень энергии:
| Серия | Лаймана | Бальмера | Пашена | Брэкета |
| Переходы | np®1s | ns®2p, nd®2p | nf®3d, np®3d | ng®4f, nd®4f |
Теория Бора позволила объяснить существование известной серии Бальмера в спектре атома водорода. Эта серия располагается в диапазоне видимого света и состоит из ряда линий. Линия с наибольшей длиной волны, или с наименьшей частотой, называется Hα; следующая голубовато-зеленая линия - Hβ; далее следует фиолетовая линия Hγ и т.д.
Серия Бальмера (и другие известные серии) являются прямым доказательством существования дискретных энергетических уровней у атома водорода.
 2015-06-24
2015-06-24 3425
3425