| Определение | • связь, возникающая за счет обобществления и локализации электронов (общей электронной пары) между взаимодействующими атомами; значения энергии связи ~ 102−103 кДж/моль |
| Свойства ковалентной связи | • к основным свойствам ковалентной связи относятся её насыщаемость, направленность и поляризуемость |
| Насыщаемость | • свойство, состоящее в том, что образование связывающей два атома электронной пары исключает ее участие в других химических взаимодействиях, благодаря чему ковалентные соединения имеют строго определенный состав |
| Направленность | • при образовании ковалентной связи максимально возможное перекрывание электронных облаков обеспечивается их расположением по определенным направлениям |
| Поляризуемость | • способность атомов, молекул, ионов приобретать дипольный момент под действием внешнего электрического поля или под действием другой молекулы или иона |
| МВС – метод валентных связей. | • основные положения: а) связь образуется за счет перекрывания электронных облаков, приводящего к возникновению в межъядерном пространстве зоны с повышенной электронной плотностью; б) чем сильнее перекрываются электронные облака атомов, тем прочнее, при прочих равных условиях, образующаяся связь |
| Схема образования молекулы H2 по МВС H↑+H↓→ → H↑↓ H→ →H – H | •1927г. Гейтлер и Лондон разработали метод валентных связей (сначала для молекулы H2); при сближении двух атомов, валентные электроны которых имеют антипараллельные спины (↑↓), образуется общая электронная пара; повышается электронная плотность в пространстве между ядрами атомов и выделяется энергия: при образовании 1 моль молекул Н2 выделяется энергия 436 кДж; если же сближаются атомы с параллельными спинами электронная плотность в пространстве между ядрами понижается, молекула не образуется. |
| Гибридиза-ция атомных орбиталей | •усреднение (выравнивание) энергий и пространственной конфигурации различных АО в атоме в результате перераспределения электронной плотности; • существуют следующие типы гибридизации sp, sp2, sp3, dsp2, sp3d, sp3d2, sp3d3, sp3d2f и т.д. |
| sp-гибридиза-ция | • при гибридизации одной s- и одной p- орбиталей; образуются две sp-гибридные орбитали с линейной симметрией (угол между осями гибридных орбиталей 1800); например молекула: BeH2 Н − Be − H |
| sp2-гибридиза-ция | • гибридизируются одна s- и две p- орбитали; образуются три гибридные sp- орбитали; гибридные орбитали расположены под углом 1200 друг к другу;
 например: BF3 F например: BF3 F
  B
F F B
F F
|
| sp3-гибридиза-ция | • гибридизируются одна s- и три p- орбитали; получаются четыре гибридные sp- орбитали, образующие тетраэдрическую конфигурацию (угол − 109028' )
Например: CH4
 H H
   C
H H
H C
H H
H
|
| Другие типы гибридизации | • Существуют и другие типы гибридизации атомных орбиталей, например: sp3d, sp3d2, sp3d3, dsp3, d3sp, d2sp2, d4s, d2sp3, d3sp3, d4sp3. |
| Типы ковалентной связи | |
| Неполярная ковалентная связь | • общая электронная пара расположена на равном расстоянии (симметрично) от ядер атомов с одинаковой электроотрицательностью; пример H2, N2, O2, Cl2. |
| Полярная ковалентная связь | • общая электронная пара смещена в сторону элемента с большим значением электроотрицательности (ЭО); • cуществует ассиметрия в расположении общей электронной пары, что может приводить к возникновению электрического диполя: пример HCl, SO2, H2O, NH3 |
 Донорно-акцепторный механизм образования ковалентной связи Донорно-акцепторный механизм образования ковалентной связи
| • общая электронная пара взаимодействующих атомов образуется за счет неподеленной электронной пары одного атома (донор) и вакантной орбитали другого (акцептор)
Например, ион NH4+
 N донорная
орбиталь
N донорная
орбиталь
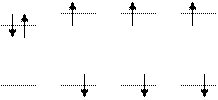 H+ H H H
акцепторная
орбиталь
H+ H H H
акцепторная
орбиталь
|
| Кратность связи | • число общих электронных пар, соединяющих атомы в молекуле
H2 − 1(H − H), HF − 1(H − F), O2 −2(O = O),
 N2 −3(N≡N), CO −3 (C = O)* N2 −3(N≡N), CO −3 (C = O)*
|
| Энергия связи (прочность), E (кДж/моль) | •энергия, выделяющаяся при образовании связи или необходимая для разрыва связи; •может быть рассчитана на одну молекулу (измеряется в эВ) или на 1 моль молекул (измеряется в кДж/моль) E св (H2) – 436 кДж/моль E св (F2) – 151 кДж/моль Eсв (N2) – 950 кДж/моль Eсв (CO) – 1076 кДж/моль; • это означает, что, например, при образовании, 1 моль молекул H2 из атомов Н выделяется 436 кДж энергии, а для разрушения 1 моль молекул N2 на атомы N необходимо затратить 950 кДж |
| Длина связи, d (нм) | •межъядерное расстояние в молекуле •чем больше длина связи, тем меньше (при прочих равных условиях) ее прочность Cl2 (d св = 199нм, Eсв = 243 кДж/моль), Br2 (d св = 228нм, Eсв =194 кДж/моль) |
| Типы перекрывания атомных орбиталей | • σ-перекрывание − перекрывание АО, расположенных вдоль прямой линии, соединяющей ядра атомов (s−s, s−p, p−p, sp−sp, sp−s, sp−p); • одинарная связь – всегда σ-связь; примеры молекул с σ-связью: Н2, F2, HCl, H2O, NH3. • π-перекрывание возникает у p-АО, расположенных перпендикулярно линии, соединяющей ядра атомов; это происходит при образовании двойной или тройной связи: в молекуле O=O 1σ- и 1π- связь; в молекуле N≡N 1σ- и 2π- связи; в молекуле O=C=O 2σ- и 2π- связи; π - связь слабее σ –связи; δ (дельта) – связь образуется при перекрывании d – AO c d – AO |
Ковалентная связь
|
|

Сейчас читают про:
 2015-06-26
2015-06-26 482
482







