Все ферменты разделены по их действию на 6 классов (табл.7.1).
1-й класс. Оксидоредуктазы. Катализаторы окислительно-восстановительных реакций. Пример: каталаза, пероксидаза, дегидрогеназы, оксигеназы.
2-й класс. Трансферазы - катализаторы переноса отдельных групп с одной молекулы субстрата на другую, например: трансаминазы, метилтрансферазы и др. Среди трансфераз особо выделяют
3-й класс..
4-й класс. Лиазы катализируют разрыв химических связей без гидролиза с образованием двойной связи в одном из продуктов.
5-й класс. Изомеразы ускоряют всевозможные структурные или геометрические изменения в молекуле субстрата (реакции изомеризации). Например, фосфоглюкоизомераза и фосфоглицератизомераза в гликолизе.
6-й класс. Лигазы, или синтетазы
Будучи катализаторами, ферменты ускоряют как прямую, так и обратную реакции, поэтому, например, лиазы способны катализировать и обратную реакцию — присоединение по двойным связям.
Каждый класс ферментов разделен на подклассы. В подклассе могут быть подподклассы. В подподклассе отдельным Например, трипсин относится к классу гидролаз 3, подклассу пептидгидролаз 4, подподклассу сериновых протеиназ 21, порядковый номер в подподклассе 4. Следовательно, шифр трипсина 3.4.21.4.
Таблица 1 - оптимум рН активности ферментов
| Фермент и субстрат | Оптимум рН | Фермент и субстрат | Оптимум рН |
| Пепсин | Трипсин | ||
| Яичный альбумин | 1,5 | Бэнзоиларгининамид | 7,7 |
| Гемоглобин | 2,2 | Этиловый эфир бензоиларгининамида | 7,0 |
| Пируваткарбоксилаза | |||
| Пируват | 4,8 | Щелочная фосфатаза | |
| Фумараза | Глицеро-3-фосфат | 9,5 | |
| Фумарат | 6,5 | Аргиназа | |
| Малат | 8,0 | Аргинин | 9, 7 |
| Каталаза | |||
| Перекись водорода | 7,6 |
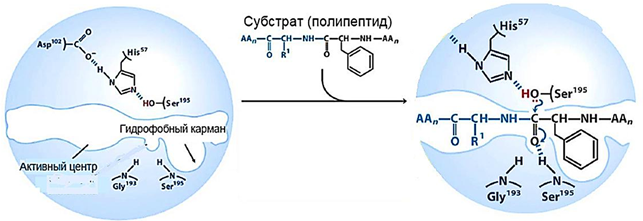
Рисунок 4 - взаимодействие каталитического центра химотрипсина с субстратом
Химотрипсиновый катализ напоминает катализ щелочью. Роль основания здесь выполняют гидроксил серина и имидазол гистидина, являющиеся вместе основаниями, т.к. являются донорами электронной пары.
Чтобы понять механизм химотрипсинового катализа, надо иметь в виду, что во-первых, пептидная связь прочная, она на 40% двойная. Разрыв ее происходит в тот момент, когда вокруг углерода пептидной связи все валентные связи одинарные: тетраэдрическая конфигурация.
Во-вторых, компоненты активного центра химотрипсина: имидазол гистидина, карбоксильная группа аспарагиновой кислоты и гидроксил серина, находящиеся в полипептидной цепи далеко друг от друга, в третичной структуре располагаются рядом и связаны между собой электронной цепочкой. Электроны движутся от гистидина через аспарагиновую кислоту к гидроксилу серина, где наблюдается избыток электронов (рис.4).
И, в-третьих, после разрыва пептидной связи образуется 2 продукта: ацильный и аминный.
Последовательность событий в химотрипсиновом катализе следующая.
1. На первой стадии после закрепления субстрата на активном центре фермента пептидная связь атакуется электронами серина.
2. В результате атаки валентные связи карбонильного углерода в пептиде приобретают тетраэдрическую конфигурацию, пептидная связь ослабляется и разрывается. До момента разрыва фермент и субстрат некоторое время находятся вместе в виде фермент-субстратного комплекса.
3. После разрыва связи из комплекса высвобождается аминный продукт реакции. Ацильный компонент субстрата остается связанным с ферментом сложноэфирной связью. Это соединение называется ацилферментом - это феpмент-продуктный комплекс.
4. На второй стадии катализа ацилфермент атакуется электронами воды и высвобождается ацильный продукт реакции. После этого фермент приобретает исходное состояние.
В рассмотренной модели катализа, предложенной Д. Блоу, все решает активный центр. Об остальной части громадной молекулы фермента нет речи. Очевидно, это не так. Согласно представлениям Д. Кошланда, вся молекула белка-фермента способствует катализу. После того, как субстрат прочно зафиксирован на ферменте, незначительные сдвиги в третичной структуре всей молекулы белка (фермента) приводят к существенным изменениям в районе активного центра. И катализируемая связь разрывается. Гипотеза Д. Кошланда называется гипотезой "дыбы".
В конце XIX века Э. Фишер, изучая специфичность ферментов, показал, что субстрат подходит к ферменту, как «ключ к замку», т.е. обнаружил явление стереоспецифичности.
Согласно Д. Кошланду, фермент соответствует субстрату, как «рука перчатке». Имеется в виду факт изменения третичной структуры фермента при взаимодействии с субстратом.
 2015-06-26
2015-06-26 383
383






