Колебательное движение – называют движения или процессы точно, или приблизительно повторяющиеся через равные промежутки времени. Среди них важную роль играют периодические движения.
Примерами периодического движения могут служить движение планет вокруг Солнца, движение поршня в цилиндре и так потом.
Тело, выведенное из состояния равновесия и предоставленное самому себе, совершают колебания около положения равновесия – такие колебания называют собственные или свободные.
Свободные колебания являются не только самыми распространенными, но и самыми важными в теории колебаний, так как условия возникновения других колебаний существенно зависит от их характера.
Вынужденное колебание.
Колебания, возникающие под действием внешних периодически изменяющейся силы- называют вынужденными колебаниями.
Величины характеризующие свободные колебания:
1. Амплитуда- любое колебательное движение характеризуется амплитудой А-значением максимального отклонения колеблющейся точки от положения равновесия.
|
|
|
2. Частота- величина показывающая число полных колебаний, совершаемых за единицу времени. Частота- величина обратная периоду.
3. Период колебаний – T- времени, в течении которого совершается одно полное колебание.
Единица периода- секунда(с).
При колебательном движении происходит превращение энергии потенциальной в кинетическую и наоборот.
Билет№10
Диффузия – перемешивание газов, жидкостей и твердых тел при непосредственном контакте.
Причины броуновского движения частицы заключается в том, что удары молекул жидкости о частицы не компенсируют друг друга.
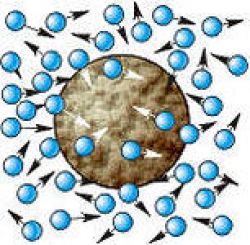 При беспорядочном движении молекул передаваемые ими броуновской
При беспорядочном движении молекул передаваемые ими броуновской
частице импульсы, например слева и справа неодинаковы, поэтому
отлична от нуля результирующая сила давления молекул жидкости на
броуновскую частицу, которая и вызывает изменение движения.
Силы взаимодействия молекул.
Если молекулы существуют и движутся, то между ними обязательно должны действовать силы. Без этого взаимодействие не было ни твердых ни жидких тел.
Строение газообразных, жидких и твердых тел. Молекулярная-кинетическая теория дает возможность понять почему вещество может находится в газообразном, жидком, твердом состоянии.
Газы. В газах расстояние между атомами или молекулами в среднем во много раз больше размеров самих молекул. Например: при атмосферном давлении объем сосуда в десятки тысяч раз больше превышает объем находящихся в нем молекул.
Газы могут неограниченно расщепляться. Они не сохраняют не формы ни объем. Многочисленные удары молекул о стенки сосуда создают давление газа.
|
|
|
Жидкости. Молекулы жидкости расположены почти вплотную друг к другу, поэтому молекулы жидкости ведет себя иначе, чем молекулы газа.
Молекула – это сложная система, состоящая из отдельных запряженных частиц: электронов и атомных ядер.
Атомы и молекулы состоят из электрически заряженных частиц. Благодаря действию электрических сил на малых расстояниях они притягиваются, но начинают отталкиваться, когда электронные оболочки атомов перекрываются.
Твердые тела - сохраняют не только форму, но и объем.
Идеальный газ -это газ, взаимодействие между молекулами которого пренебрежительно мало.
Билет№11
Давление газа в молекулярно-кинетической теории. Пусть газ находится в закрытом сосуде. Мономер показывает давление газа p:
Каждая молекула газа, ударялась о стенку, в течение малого промежутка времени действует на нее с определенной силой. В результате беспорядочных ударов о стенку, давление быстро меняется со временем. Однако действия вызванные ударами отдельных молекул настолько слабы, что манометром они не регистрируются.
В результате многочисленных ударов дробинок на диск действует некоторая средняя сила давления, вызывающая поворот стержня и изгиб упругой пластины. Эффект от ударов отдельных дробинок не заметен. P=1/3 n.m.
Основное уравнение молекулярно-кинетической теории определяет макроскопическую величину- давление газа через концентрацию n молекул, массу м., отдельных молекул и среднюю квадратическую скорость <v кв.> их движения.
Температурный параметр должен изменяться при изменение температуры непрерывно и монотонно, т.е. он не должен иметь одинаковых значений при разных температурах.
Способ деления шкалы введен А. Цельсием. Градус по шкале цельсия обозначается 0с.
Термодинамические 0t пропорциональна средней кинетической энергии хаотического движения молекул газа. PV=m/м*RT.
V1/V2=P2/P1
T1/T2=V1/V2
T1/T2=P1/P2
Билет№12
Состояние данной массы газа характеризуется 3 макроскопическими параметрами: давление, объем, темп.
Объем V(m3), давление P(Па), темп Т(к)
Уравнение состояния идеального газа PV=m/м*RT
Изопроцессы - протекающие при неизмененном значении, из одного параметров.
Газовые законы-количественная зависимость, между двумя параметрами газа, при постоянной массе и неизмененном значении 3 параметра.
Идеальный газ называют такой газ, для которого можно пренебречь размерами молекул, силами молекулярного взаимодействия, соударения молекул в таком газе происходит по закону соударения упругих шаров.
Билет№13
Самое интересное состояние газа – это насыщенный пар. Он находится в равновесии с жидкостью;
Его давление и плотность не зависит от объема.
Пар находящиеся в динамическом равновесии со своей жидкостью называют насыщенным паром.
Давление пара р, при котором жидкость находится в равновесии со своим паром, называют давлением насыщенного пара.
Свойство давление пара.
При сжатии насыщенного пара все большая часть его переходит в жидкое состояние. Жидкость данной массы занимает объем, чем пар той же массы. В результате объем пара при неизменной его плотности уменьшается.
При постоянной t0 установится динамическое равновесие между жидкостью и паром.
Если сжимать пар, находящийся в равновесии с жидкостью в цилиндре под поршнем, поддерживая t0 содержимой цилиндра постоянной.
Относительной влажностью воздуха называют- отношение парциального давления р водяного пара, содержащегося в воздухе при данной t0 к давлению насыщенного пара при той же t0, выраженной в процентах: ф=р/p0100%.
От влажности зависит интенсивность испарения влаги.
 2015-07-14
2015-07-14 4526
4526
