Удельная электропроводность растворов электролитов. Электрический ток есть упорядоченное перемещение заряженных частиц. Растворы электролитов обладают ионной проводимостью (являются т.н. проводниками второго рода), т.е. электропроводность растворов электролитов обусловлена перемещением ионов в электрическом поле (в отличие от электронной проводимости проводников первого рода).
Величина преимущественного передвижения иона в направлении одного из электродов при прохождении тока через раствор отнесённая к градиенту потенциала 1 В/см, есть абсолютная скорость движения иона. Абсолютные скорости движения катионов U+ и анионов U–различаются; это приводит к тому, что ионы разных знаков переносят разные количества электричества.
Всякий проводник, по которому течет ток, представляет для него определенное сопротивление R, которое, согласно закону Ома, прямо пропорционально длине проводника l и обратно пропорционально площади сечения S; коэффициентом пропорциональности является удельное сопротивление материала ρ – сопротивление проводника, имеющего длину 1 см и сечение 1 см2:
|
|
|
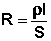 , Ом (III.32)
, Ом (III.32)
В качестве количественной меры способности раствора электролита проводить электрический ток используют обычно удельную электропроводность κ (каппа) – величину, обратную удельному сопротивлению (т.е. величину, обратную сопротивлению столба раствора между электродами площадью 1 см2, находящимися на расстоянии 1 см):
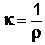 , Ом-1см-1 (III.33)
, Ом-1см-1 (III.33)
Величина удельной электропроводности электролита зависит от ряда факторов: природы электролита, температуры, концентрации раствора. Удельная электропроводность растворов электролитов (в отличие от электропроводности проводников первого рода) с увеличением температуры возрастает, что вызвано увеличением скорости
Молярная электропроводность растворов электролитов. Молярная электропроводность раствора λ есть величина, обратная сопротивлению раствора, содержащего 1 моль растворенного вещества и помещенного между электродами, расположенными на расстоянии 1 см друг от друга. С удельной электропроводностью κ и молярной концентрацией раствора С молярная электропроводность связана следующим соотношением:
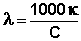 , Ом-1см2моль-1 (III.34)
, Ом-1см2моль-1 (III.34)
Молярная электропроводность как сильных, так и слабых электролитов увеличивается с уменьшением концентрации (т.е. увеличением разведения раствора V = 1/С
Доля электричества, которая переносится через электролит данным ионом, называется его числом переноса. Оно может быть найдено из уравнения, которое определяет количество электричества, прошедшего через сечение электролита, равное 1 см2за 1 с, и из приводившихся выше уравнений для количеств электричества, переносимого ионами. Таким образом, числа переноса
|
|
|
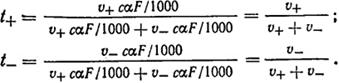
Учитывая, что υ = k при E = 1 В/см и Fk = 1, находим
t+ = l+/(l+ + l-); (VII1.7) t- = l-/(l+ + l-)., t+ + t- = 1.
Из уравнений (VIII.7) и (VIII.8) видно, что числа переноса определяются подвижностями ионов: чем больше подвижность данного иона, тем большую долю электричества он переносит. Подвижность иона зависит от его размера и заряда. Большие ионы, например, анионы органических кислот в водных растворах или сложные кремнийкислородные анионы в расплавленных шлаках, характеризуются малой подвижностью и, следовательно, малыми величинами t-.
Электролизом называется процесс разложения расплавов или растворов электролитов под действием постоянного электрического тока. Окислительно-восстановительные реакции, связанные с отдачей или присоединением электронов при электролизе, происходят на электродах. Положительный электрод, к которому подходят анионы, называется анодом, отрицательный электрод, к которому подходят катионы, назывется катодом. Как будут протекать электродные процессы при электролизе зависит, прежде всего, от природы электролита, от того, находится ли электролит в виде расплава или используется его раствор, и от матерала электродов.
Электролиз расплава. Рассматрим электролиз расплава хлористого натри: катионы Na+ будут перемещаться к катоду, а анионы Cl- - к аноду. На катоде (отрицательно заряженном электроде) катионы Na+ присоединяют к себе электроны (восстанавливаются), образуя металлический натрий:
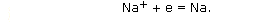
Анод (положительно заряженный электрод) выступает по отношению к анионам хлора как окислитель - отбирает у них электроны: 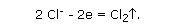
Суммарное уравнение электролиза: 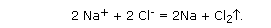
Электролиз растворов. В растворе, например хлористого натрия, кроме ионов Na+ и Cl- имеются в небольшом количестве и ионы, получемые при диссоциации воды: 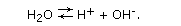
На отрицательно заряженном электроде (катоде) молекулы воды могут присоединять электроны: 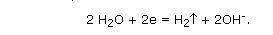
На аноде (положительно заряженном электроде) молекулы воды могут отдавать электроны: 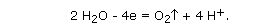
Итак, на катоде при электролизе раствора NaCl могут протекать следующие процессы:
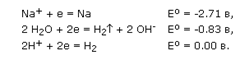
На аноде при электролизе раствора NaCl могут протекать следующие процессы: 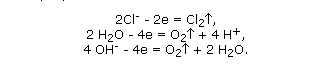
Суммарный процесс электролиза раствора хлористого натрия выглядит так: 2H2O + 2NaCl = H2 + 2NaOH + Cl2.
Инертные электроды.1. В первую очередь окисляются простые анионы (Cl-, Br-, I-, S2-). 2. Вместо кислородосодержащих кислотных анионов (CO3-, NO3-, SO42-, PO43-) на аноде окисляются молекулы воды. 3. В щелочных растворах на аноде окисляются ионы гидроксила: 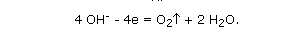
Растворимые электроды. При использовании растворимых анодов (Cu, Zn, Ag, Ni) электроны отдают атомы металлов: 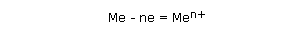 и образующиеся при этом катионы металлов Men+ переходят в раствор.
и образующиеся при этом катионы металлов Men+ переходят в раствор.
Законы Фарадея – основные законы электролиза. Устанавливают взаимосвязь между количеством электричества, проходящего через электропроводящий раствор (электролит), и количеством вещества, выделяющегося на электродах.
Первый закон ФАРАДЕЯ: масса вещества m, выделяющегося на электроде, при прохождении электрического тока прямо пропорциональна значению q электрического заряда, пропущенного через электролит: m = kq,
где k – электрохимический эквивалент вещества, численно равный массе вещества, выделившегося при прохождении через электролит единицы количества электричества. При пропускании через электролит постоянного тока I в течение секунды q = It, m = kIt.
Второй закон ФАРАДЕЯ: электрохимические эквиваленты элементов прямо пропорциональны их химическим эквивалентам.
 2015-08-12
2015-08-12 1220
1220








