Под воздействием подвода или отвода энергии в форме теплоты или работы происходит изменение состояния термодинамической системы значений термодинамических параметров), называемое термодинамическим процессом. Процессы, представляющие собой непрерывный ряд равновесных состояний, называют равновесными. При этом равновесным считают состояние, в которое приходит система при постоянных внешних условиях, характеризуемое неизменностью во времени термодинамических параметров и отсутствием в системе потоков вещества и теплоты.
Устойчивое равновесие характеризуется следующими общими условиями.
1) неизменностью равновесного состояния системы во времени при постоянных внешних условиях. 2) подвижностью равновесия (самопроизвольным восстановлением состояния равновесия после снятия внешнего воздействия, вызвавшего отклонение системы от положения равновесия), 3) динамическим характером равновесия, т. е. установлением и сохранением равновесия вследствие равенства скоростей прямого и обратного процессов, 4) возможностью подхода к состоянию равновесия с двух противоположных сторон. 5) минимальным значением энергии Гиббса G в изобарно-изотермических и энергии Гельмгольца F в изохорно-изотермических процесса» (dG 0 d2G > 0, dF 0, d2F > 0)
Из этих общих условий выводятся конкретные условия для химического равновесия.
Химические реакции, как правило, обратимы: наряду с химическим вмимодействием между исходными веществами (прямая реакция) протекает взаимодействие и между продуктами (обратная реакция). По мере протекания процесса скорость прямой реакции уменьшается, а скорость обратной реакции увеличивается; в какой-то момент времени скорости прямой и обратной реакций становятся равными — наступает состояние химического равновесия. Химическое равновесие характеризуется неизменностью числа молекул веществ, составляющих химическую систему, при неизменных внешних условиях. Так как условием равновесия при постоянных Т и р служит минимум энергии Гиббса (dG 0), то в условиях химического равновесия должно также соблюдаться равенство: 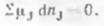
где химический потенциал компончиа J: nj — количество компонента J (моль)
Известно что химическим потенциалом называеться величина:
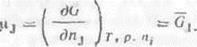
Большая положительная величина химического потенциала указывает на высокую реакционную способность частиц.
Положение равновесия всегда зависит от внешних условий, а так как внешние условия не могут сохраняться неизменными, то равновесие рано или поздно нарушается (смещается) Влияние изменения внешних условий на положение равновесия — принцип смещения равновесия, называемый в литературе принципом Ле Шателье, можно сформулировать следующим образом
если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-нибудь из условий, определяющих положение равновесия, то в системе усилится то направление процесса, течение которого ослабляет влияние произведенного воздействия, и положение равновесия сместится в том же направлении.
Влияние давления. Характер влияния давления на равновесие химических реакций определяется знаком разности числа молей газообразных участников реакции или знаком изменения объема.
Для газовых реакций, в которых число молей npoдvктoв превышает число молей реагентов, т. е. n > 0, увеличение давления неблагоприятно. Смещению равновесия реакции вправо способствует снижение давления. Если же реакция протекает с уменьшением числа молей (n < 0), повышение давления целесообразно — оно смещает равновесие реакции в сторону образования продуктов.
Чувствительность потожения равновесия к изменениям давления тем больше, чем большим изменением объема V (или n) сопровождается тот или иной процесс. Значительные изменения объема могут происходить только в реакциях, в которых участвуют газы, или в тех случаях, когда хотя бы один из компонентов находится в газообразном состоянии.
Влияние инертного газа. Введение инертного газа в систему при р=const подобно эффекту уменьшения об цего давления. Если реакция протекает с уменьшением числа молей (n < 0), разбавление инертным газом смещает равновесие реакции в сторону исходных реагентов; при увеличении числа молей (n > 0) равновесие смещается вправо. Поэтому в технологических процессах, сопровождаемых химическими реакциями, для которых n < 0, стремятся к уменьшению накопления инертных газов в системе. Так, если в азотноводородноаммиачной смеси, взятой при р = 100 МПа, содержалось бы 10% инертного газа, то это равносильно снижению давления на 25 МПа. С целью поддержания высоких выходов аммиака в системе регулярно проводятся «продувка» и добавление свежего газа.
Выводы о влиянии инертного газа непосредственно следуют и из закона Дальтона
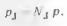
из которого видно, что эффект разбавления (уменьшения Nj) подобен эффекту уменьшения общего давления р в системе.
Влияние концентрации. В соответствии с принципом, Ле Шателье введение в равновесную систему дополнительных количеств какого-либо вещества вызывает смещение равновесия в том направлении, при котором концентрация этого вещества уменьшается. Поэтому введение избытка исходных веществ смещает равновесие вправо; введение избытка продукта вызовет смещение равновесия влево
Увеличивая концентрацию одного из реагентов (создавая его избыток), можно повысить степень превращения другого. Этим широко пользуются в химической технологии, добиваясь полного превращения дорогостоящего компонента сырья.
Во многих случаях смещение равновесия процесса вправо можно осуществить и выводом продуктов из реакционной зоны - уменьшением концентрации продукта.
Влияние температуры. Направление смещения равновесия при изменении температуры зависит от знака теплового эффекта реакции. Повышение температуры всегда благоприятствует накоплению веществ, образующихся в данной реакции с поглощением теплоты, т.е. усиливает эндотермическое направление процесса. Понижение температуры действует в противоположную сторону, т. е. усиливает экзотермическое направление.
При изменении температуры процесса равновесие смещается в направлении, для которого изменение энтропии имеет тот же знак, что и изменение температуры. Учет знака теплового эффекта реакции (Н < 0) приводит к тому же выводу повышение температуры смещает равновесие в сторону исходных реагентов (усиливает эндотермическое направление реакции), понижение температуры действует в противоположном направлении.Следует отметить, что при изменении температуры равновесие смещается тем сильнее, чем большим тепловым эффектом сопровождается та или иная химическая реакция.
36. Гравиметрический анализ, весовой анализ, один из важных методов количественного химического анализа, основанный на точном измерении массы вещества. Определяемое вещество обычно выделяют из анализируемой пробы в виде малорастворимого соединения известного постоянного химического состава, т. к. выделение вещества в химически чистом виде связано с большими трудностями, а иногда и невозможно. Гравиметрический анализ начинается с взятия точной навески анализируемой пробы и перевода её в раствор. Затем, прибавляя соответствующий реактив, получают малорастворимый осадок соединения, содержащего определяемое вещество. Осадок отделяют от раствора фильтрованием, промывают и сушат или прокаливают до постоянного значения массы. Зная навеску анализируемой пробы а, массу осадка b и его состав, вычисляют содержание определяемого вещества Х (обычно. в % по массе): X = a×F×100/b, где F — фактор пересчёта, представляющий собой отношение атомной массы определяемого вещества (или величины, кратной атомной массе) к молекулярной массе соединения в осадке. Например, при определении содержания железа (атомной масса 55,85), выделенного в виде его окиси Fe2O3 (молярная масса 159,70),
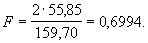
Наиболее ответственная операция гравиметрического анализа — получение легко фильтрующегося (по возможности крупнокристаллического) малорастворимого осадка (потеря вещества вследствие его растворимости не должна превышать 0,1 мг), свободного от примесей посторонних веществ, не удаляющихся при сушке или прокаливании. Гравиметрический анализ отличается большой точностью: относительная ошибка опыта не превышает 0,1%, а при особо тщательной работе может быть доведена до 0,02—0,03%. Недостатки гравиметрического анализа — длительность выполнения и необходимость применения сравнительно больших количеств анализируемой пробы (~0,5 г). Последний недостаток устраняется при использовании микро- и ультрамикрометодов гравиметрического анализа (подробнее см. Микрохимический анализ). Гравиметрический анализ применяют для определения химического состава горных пород, минералов, сплавов, для контроля качества сырья и готовой продукции в ряде отраслей промышленности. К разновидностям гравиметрического анализа относятся пробирный анализ и электрогравиметрический анализ.
 2015-08-12
2015-08-12 7710
7710
