Металлический проводник не принимает участия в электродной реакции, а служит для передачи электронов от газа к ионам в растворе и наоборот.
Водородный электрод - это инертный металл (чаще всего платинированная платина), соприкасающийся с ним электролит с определенным рН и газообразный водород (Н2), омывающий металл в виде пузырьков.
На границе раздела фаз Pt, H2 | раствор в зависимости от рН раствора устанавливается равновесие:
а) в кислой среде (рН < 7)
2H+ + 2e D H2 (7)
схема водородного электрода
Pt, H2 | H+ (8)
б) в щелочной и нейтральной средах (рН ³ 7)
H2O + 2e D H2 +2OH (9)
схема водородного электрода
Pt, H2 | OH-
Величина потенциала водородного электрода j(н2), B зависит от рН раствора и при Т = 298К определяется:
j(Н2) = -0,059 рН (10)
Кислородный электрод – это металл, соприкасающийся с ним электролит с определенным рН и газообразный кислород, омывающий металл в виде пузырьков.
На границе раздела фаз Рt, O2| раствор в зависимости от рН раствора устанавливается равновесие:
а) в кислой среде (рН < 7)
|
|
|
О2 + 4Н++4е D 2Н2О (11)
схема кислородного электрода
Рt, O2 |Н+ (12)
б) в щелочной и нейтральной средах (рН³7)
О2 + 2Н2О + 4еD 4ОН- (13)
схема кислородного электрода
Рt, O2 | ОН- (14)
Величина потенциала кислородного электрода j(О2) при Т = 298К и максимальной растворимости кислорода в воде при этой температуре, равной С(О2) = 2,6×10-4 моль/л, рассчитывается по уравнению:
j(О2) = 1,213 - 0,059рН (15)
Расчет рН = -lgC(H+) и соответственно потенциалов кислородного и водородного электродов сводится к определению концентрации Н+ ионов в растворе:
а) в растворах кислот:
С(Н+)=N(H+)×C(кислоты)×a(кислоты) (16)
б) в растворах оснований С(Н+)= 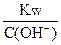 ,
,
где Кw=[H+]×[OH-]= 10-14 при 298K (17)
С(ОН-) = N(ОН-)×C(основания)×a(основания) (18)
Диссоциация слабой кислоты и слабого основания характеризуется константой электролитической диссоциации –Кд.
Например,
HCN D H+ + CN- Kд = 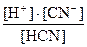 (19)
(19)

NH4OH D NH4+ +OH- Кд = 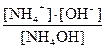 (20)
(20)
Для разбавленных растворов электролитов между Кд и a существует зависимость (закон разведения):
Кд = С×a2 (21)
Пример 4. Рассчитайте потенциалы кислородного и водородного электродов в 0,1М растворе угольной кислоты при 298К, если Кд1(Н2СО3) = 4,45×10-7. Напишите уравнения равновесия на электродах в этом растворе.
Решение: j(Н2) = - 0,059рН; j(О2) = 1,213 – 0,059рН.
Решение сводится к определению С(Н+) в растворе.
Угольная кислота – слабая и диссоциирует, в основном, по 1 ступени:
Н2СО3 D Н+ + СО32-, N(H+) = 1
Отсюда: С(Н+) = С(Н2СО3)×a (Н2СО3)
Подставляя a = 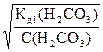 , полученное из (21) в уравнение (16) получаем:
, полученное из (21) в уравнение (16) получаем:
С(Н+)= 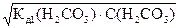 =
= 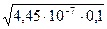 =2,1×10-4 моль/л.
=2,1×10-4 моль/л.
Тогда рН = –lg2,1×10-4 = 3,67
j(Н2)=-0,059×3,67=–0,216B, j(O2)=1,2130,059×0,3,67=0,997B
Равновесия на границах раздела фаз
Водородный электрод Кислородный электрод
|
|
|
2Н+ + 2е D Н2 О2 + 4Н+ + 4е D 2Н2О
Пример 5. Потенциал водородного электрода в 0,01М растворе гидроокиси аммония при 298К равен -0,627В. Рассчитайте константу диссоциации гидроокиси аммония; нарисуйте схему водородного электрода.
Решение: Гидроокись аммония – слабый электролит. Диссоциация гидроокиси аммония, как слабого электролита, описывается уравнением
NH4OH D NH4 + + OH- , N(OH) = 1 (22)
Концентрация ионов ОН- в растворе равна:
С(ОН-) = С(NH4OH)×a(NH4OH)
Из закона разведения Оствальда (21) имеем
a = 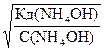
Подставив a в уравнение (18) получим
С(ОН-) = 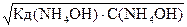 ,
,
Откуда Кд(NH4OH) = 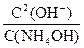 .
.
Следовательно, задача сводится к определению концентрации ОН- в растворе.
Из j(Н2) = - 0,627В = -0,059рН получаем:
рН = 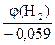 ×
× 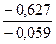 =10,627, тогда С(Н+)= 10-рН = 10-10,627
=10,627, тогда С(Н+)= 10-рН = 10-10,627
Рассчитаем С(ОН-) и Кд(NH4OH)
С(ОН-) = 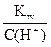 =
= 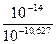 = 10-3,373 моль/л
= 10-3,373 моль/л
Кд = 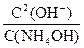 =
= 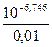 = 10-4,746 = 1,79×10-5.
= 10-4,746 = 1,79×10-5.
1.3. ЗАДАЧИ
1. Вычислите равновесный потенциал серебряного электрода при Т = 298К, опущенного в раствор AgNO3 c w = 1%, rр = 1,1942г/см3. Нарисуйте схему электрода.
2. В 200 см3 раствора содержится 0,32 г CuSO4 Рассчитайте равновесный потенциал медного электрода в этом растворе при Т = 250С и напишите уравнение равновесия на границе раздела фаз.
3. Рассчитайте потенциал кислородного при 298К в 0,01М растворе фосфорной кислоты, если она диссоциирует преимущественно по 1 ступени и Кд1(H3PO4) = 7,11×10-3 . Напишите уравнение равновесия на границе раздела фаз.
4. Рассчитайте равновесный потенциал железного электрода при Т = 250С в растворе, в 500 см3 которого содержится 70 г FeCl3, a(FeCl3) = 80%. Напишите уравнения равновесия на границе раздела фаз.
5. Цинковый электрод помещен в раствор ZnSO4, Сэк(ZnSO4) = 02686н, a(ZnSO4) = 85%, T = 250C. Рассчитайте равновесный потенциал электрода. Нарисуйте схему электрода.
6. В раствор, содержащий 63,78г NiSO4, 999,22г Н2О с плотностью rр = 1,063г/см3, поместили никелевый электрод. Рассчитайте равновесный потенциал электрода при Т = 250С и напишите уравнения равновесия на границе раздела фаз.
7. Рассчитайте потенциал водородного электрода при Т = 250С, опущенного в раствор серной кислоты с w(H2SO4) = 1%, r = 1,005г/см3. Нарисуйте схему электрода.
8. Вычислите потенциал электрода Pt,H2½NaOH, (C = 0,1M) при Т = 250С. Напишите уравнение равновесия на границе раздела фаз.
9. Вычислите потенциал кислородного электрода при Т = 250С в растворе, в 2-х литрах которого содержится 0,365г HCl. Напишите уравнение равновесия на границе раздела фаз и нарисуйте схему электрода.
10. Рассчитайте потенциал кислородного электрода в растворе HCN, C(HCN)=0,01M; Кд(HCN) = 5×10-10 при Т = 250С.
11.Вычислите концентрацию ионов кобальта в растворе СoCl2 при Т=250С, если потенциал кобальтового электрода в этом растворе равен – 0,3362В. Нарисуйте схему электрода.
12. При какой концентрации NiSO4 в растворе электродный потенциал никеля при Т=298К будет равен –0,2809В, если
a(NiSO4) = 90%. Напишите уравнение равновесия на электроде.
13. В 200 см3 раствора содержится 2,4078г сульфата магния. Вычислите степень диссоциации MgSO4 в этом растворе при Т = 298К, если потенциал магниевого электрода в растворе равен -2,4В. Нарисуйте схему Д.Э.С. на электроде.
14.Оловянный электрод образован погружением олова в раствор, содержащий 18,97 г двухлористового олова в 2-х литрах раствора. Рассчитайте a(SnCl2), если j(Sn) = -0,1806B при 298K. Нарисуйте схему электрода и Д.Э.С. на нем.
15. Кобальт погружен в раствор хлорида кобальта с концентрацией Сэк.(СoCl2) = 0,02моль-эк./л. Рассчитайте a(СoCl2)если потенциал кобальтового электрода при Т = 298К равен -0,31В. Напишите уравнение динамического равновесия на электроде.
16. Потенциал электрода Pt,H2½H2SO4 (2М) при Т = 250С равен -0,343В. Вычислите степень диссоциации H2SO4 .Напишите уравнение динамического равновесия на границе раздела фаз.
17. При 298К потенциал электрода Pb½Pb(NO3)2 (0,01M) равен -0,1917В. Вычислите степень диссоциации Pb(NO3)2 в растворе и напишите уравнение динамического равновесия на границе раздела фаз.
|
|
|
18. Вычислите концентрацию ионов Hg2+ в растворе, при которой потенциал электрода Hg½Hg2+ (Cx) равен нулю (Т = 250С). Можно ли осуществить такой электрод?
19. Индий погружен в раствор, содержащий 1,1075 г InCl3 в 500 мл раствора, a(InCl3) = 90%. Потенциал электрода при Т = 250С равен –0,3833. Рассчитайте j0(In3+/In) при 250С; нарисуйте схему электрода и напишите уравнение динамического равновесия на электроде.
20. В раствор, содержащий 50г AlCl3 в 300 г воды (r = 1,05 г/см3) погружен алюминий. Рассчитайте потенциал алюминиевого электрода в растворе (Т = 298К). Нарисуйте схему двойного электрического слоя и напишите уравнение динамического равновесия на электроде.
21. Потенциал кислородного электрода в растворе уксусной кислоты с С(СН3СООН) =0,001M при Т = 250С равен 0,984В. Определите Кд(СН3СООН), нарисуйте схему электрода.
22. Соответствует ли представленная схема Д.Э.С электроду Ni êNiSO4 (3M,a = 50%)
 Ni NiSO4(р-р)
Ni NiSO4(р-р)
- +
- +
- +
Рассчитайте потенциал никелевого электрода.
23. При какой концентрации катионов свинца (Pb2+)в растворе потенциал свинцового электрода будет равен потенциалу электрода Sn½SnCl2(0,1M) при Т = 298К. Можно ли осуществить такой свинцовый электрод?
24. Потенциал электрода из тория Th½Th4+(0,04M) равен
– 2,017В при Т = 298К. Определите j0(Th4+/Th). Какой из металлов: торий или магний более сильный восстановитель?
25. Потенциал электрода из лантана La½La3+ (0,001М) при Т = 250С равен -2,581В. Определите j0(La3+/La) и нарисуйте схему двойного электрического слоя на La. Укажите металлы, окислительные свойства которых выше, чем у лантана.
26. Рассчитайте j0(Tl1+/Tl), если потенциал таллиевого электрода в растворе, в 2-х литрах которого содержится 5,522 г азотнокислого таллия, равен - 0,454 В при Т = 298К. Нарисуйте схему Д.Э.С. на электроде.
27. j0(Be 2+/Be) = -1,847B. Возможно ли осуществить бериллиевый электрод с потенциалом, равным 0,0В, Т = 298К. Какой из металлов бериллий или стронций обладают большими окислительными свойствами?
28. Потенциал хромового электрода, погруженного в раствор 0,001М CrCl2 равен -1,003В при T = 298K, a(CrCl2) = 90%. Рассчитайте j0(Cr2+/ Cr). Нарисуйте схему электрода и Д.Э.С. на нем.
|
|
|
29. Какой из электродов Ni½Ni2+(0,0001M) или Со½Со2+(0,1М) обладает большими окислительными свойствами при Т = 298К. Ответ мотивируйте.
30. Потенциал кислородного электрода при Т = 250С равен 0,918В. Определите концентрацию катионов водорода в растворе, напишите уравнение динамического равновесия на электроде.
2. ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ.
2.1.Гальванический элемент - химический источник тока, в котором электрическая энергия вырабатывается за счет изменения свободной энергии химической реакции, протекающей в нем.
Два металла, погруженные в растворы их солей, соединенные между собой электролитическим ключом, образуют гальванический элемент. Схематически такой элемент изображается:
(А) Ме1 | Mez+(C1) || Me2z+(C2) | Me2 (K), (23)
где две вертикальные черты означают границу раздела между электродами и электролитами, одна – границу раздела фаз в электродах.
Если j1(Ме1) < j2(Ме2), то при соединении Ме1 и Ме2 между собой металлическим проводником электроны по этому проводнику самопроизвольно перейдут от электрода с меньшим потенциалом (Ме1) к электроду с большим потенциалом (Ме2). За счет этого перехода произойдет процесс окисления Ме1 с переходом в раствор катионов Me1z+и процесс восстановления катионов Mez+2 из раствора на Ме2 . Процесс окисления называется анодным, а электрод, на котором он происходит, анодом(А); процесс восстановления называется катодным, а электрод, на котором он происходит катодом(К).
В схеме гальванического элемента анод принято записывать слева, катод – справа.
Процессы протекающие в гальваническом элементе, запишутся:
Анодный процесс: Me1 -ze® Me1Z+ (окисление Ме1) (24)
Катодный процесс:Me2z+ +ze®Me2 (восстановление катионов Ме2z+) (25)
Токообразующая реакция: Me1+Ме2z+ ® Me1z++ Me2 (26)
Токообразующая реакция получается суммированием катодного(25) и анодного(24) процессов с учетом того, что число электронов в этих процессах должно быть одинаково.
Итак, причина возникновения электрического тока в гальваническом элементе – это разность потенциалов электродов, за счет которой совершается электрическая работа (Wэ):
Wэ = zFEг.э., (27)
где Ег.э. - электродвижущая сила (ЭДС) гальванического элемента, В.
ЭДС элемента - максимальная разность потенциалов, которая может быть получена при работе гальванического элемента;z –число электронов суммарного процесса.
Ег.э. = jК - jА, (28)
где jк, jA- равновесные потенциалы катода и анода элемента, В.
С другой стороны, максимальная полезная работа (Wх.р.), которую совершает система при постоянном давлении, равна изменению энергии Гиббса токообразующей реакции (27)
Wх.р. = – DGr (29)
Так как Wэ = Wх.р., то сравнивая (27) и (29) получаем:
Ег.э. = – 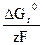 (30)
(30)
Условие самопроизвольного протекания процесса DGr<0. Отсюда термодинамическое условие работы гальванического элемента:
Ег.э.> 0 или jк>jа (31)
При стандартных условиях (с.у.)
Е0г.э. = j0к -j0а (32)
W0х.р. = - DG0r
DGro=DGfo(Me1z+) - DGfo(Me2z), Дж
DGfo(Me1z+), DGfo(Me2z+) - стандартная энергия Гиббса образования соответствующих ионов, Дж/моль (значения DG0f приводятся в термодинамических справочниках).
Пример 5. Какая из реакций:Th + 2Cr 2+ D Th4+ + Cr
DG0f 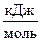 -175,63 -733,4
-175,63 -733,4
прямая или обратная осуществима в гальваническом элементе при с.у.?
Для осуществимой реакции напишите уравнения электродных процессов, нарисуйте схему Г.Э. и рассчитайте Е0г.э..
Решение 1. Рассчитаем DG0r = DG0f (Th4+) – 2 DG0f(Cr2+) = -733,4 -2×(-175,63) = - 382,14 кДж.
 DGro< 0, значит, в Г.Э. самопроизвольно протекает прямая реакция.
DGro< 0, значит, в Г.Э. самопроизвольно протекает прямая реакция.
2. Электродные процессы:
Анодный – окисление тория: Th-4e ® Th4+
Катодный – восстановление Сr2+ : 2 Сr2+ +4e®2Cr÷
3.Схема гальванического элемента
(А) Th÷ Th4+(1M) ÷÷ Cr2+(1M) ÷ Cr (K)
4.При расчетах Е0г.э. DG0r берется в Дж.
Е0г.э. = 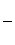
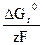 = –
= – 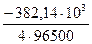 В
В
Пример 6. К аноду Ni÷ Ni2+, 0,001M, T = 298K подберите катод. Составьте схему гальванического элемента из этих электродов. Напишите уравнения электродных процессов и токообразующей реакции, рассчитайте Ег.э..
Решение. Чтобы подобрать катод к никелевому аноду, рассчитаем j(Ni2+/Ni):
j(Ni2+/Ni) = j0(Ni) + 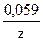 lgC(Ni2+)
lgC(Ni2+)
j0(Ni2+/Ni) = -0,25B, z = 2
j(Ni2+/Ni) = -0,25 + 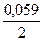 lg0,001 = -0,3385B
lg0,001 = -0,3385B
Поскольку jк > jа, т.е. jк > -0,3385В. Находим из ряда стандартных электродных потенциалов jк0 (Pb2+/Pb) = -0,126B.
Составляем схему Г.Э.:
(A) Ni÷ Ni2+,0,001M÷÷ Pb2+,1M÷ Pb(K)
Электродные процессы: A: Ni: Ni – 2e ® Ni2+
K: Pb: Pb2++2e®Pb
токообразующая реакция: Ni + Pb2+ ® Ni2+ + Pb
Eг.э. = jк - jа = j0(Pb) - j0(Ni) = -0,126 +0,3385 =0,2125B
2.2. Концентрационный гальванический элемент – состоит из электродов одинаковых по своей природе, которые различаются концентрацией электролитов.
Схема концентрационного Г.Э.:
Ме | Mez+(C1) || Mez+(C2) | Me
Если C1(Mez+) < C2(Mez+), то согласно уравнению Нернста (5) j1 < j2, и электрод 1 будет анодом, а электрод 2 - катодом.
Электродные процессы.
Анодный: Me - ze ® Mez+ (33)
Катодный: Mez+ + ze ® Me (34)
Eг.э. = jк - jа = 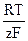 ×lg
×lg 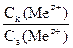 (35)
(35)
Концентрационный Г.Э. работает до тех пор, пока концентрации катионов металлов у катода и анода не сравняются.
Пример 7. Вычислите при Т = 298К ЭДС концентрационного гальванического элемента, составленного из двух оловянных электродов, погруженных в растворы С1(SnCl2) = 1M, a(SnCl2) = 90%, С2(SnCl2) = 0,001M, a(SnCl2) = 100%. Нарисуйте схему элемента. Напишите уравнения электродных процессов.
Решение: Из уравнения диссоциации:
SnCl2 D Sn2+ + Cl1- находим N(Sn2+) = 1, z(Sn2+) = 2
Из С(Sn2+) = N(Sn2+) × С(SnCl2)× a(SnCl2) получаем:
С1(Sn2+) = 1×1×0,9 = 0,9моль/л, С2(Sn2+) = 1×0,001×1 = 0,001 моль/л. Так как С1(Sn2+) > С2(Sn2+), то С1(Sn2+) = Ск(Sn2+), С2(Sn2+) = СA(Sn2+),
Отсюда Ег.э.= 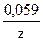 ×lg
×lg 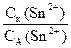
 =
= 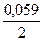 ×lg
×lg 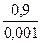 = 0,087B
= 0,087B
Схема электрода:(А) Sn÷ Sn2+ (0,001M)ïïSn2+(0,9M)ïSn (K)
Электродные процессы: А: Sn- 2e® Sn2+ (окисление Sn)
K: Sn2+ + 2e ® Sn0 (восстановление Sn2+)
2.3. ЗАДАЧИ.
31. Вычислите ЭДС гальванического элемента при 298К:
(А) Zn½ZnCl2, 0,0102M½½AgNO3,0,001M½Ag (K)
Напишите уравнения электродных процессов и токообразующей реакции.
32. Гальванический элемент состоит из двух водородных электродов в растворах соляной кислоты: С1(HCl) = 0,5M,a1 = 90%, C2(HCl) = 0,001M. Рассчитайте ЭДС этого элемента при 298К, напишите уравнения электродных процессов. Нарисуйте схему Г.Э.
33. ЭДС гальванического элемента:
(А)Сu½CuSO4(0,01M)½½Tl(NO3)3½Tl(K)
при 298К равна 0,894В. Вычислите стандартный электродный потенциал таллиевого электрода j0(Tl3+/Tl); напишите уравнения электродных процессов и токообразующей реакции.
34. Токообразующая реакция в гальваническом элементе описывается уравнением:
2Al + 3Cd2+ D 2Al3+ + 3Cd
DGf, кДж/моль -77,8 -480,6
Рассчитайте Е0г.э., напишите уравнения электродных процессов. Сколько электронов принимает участие в процессе.
35. Анод в гальваническом элементе образован погружением Со- пластины в раствор с С(Со2+) = 0,03М, Т = 298К. Подберите к этому аноду катод, составьте схему Г.Э. из этих электродов; напишите уравнения электродных и токообразующего процессов. Рассчитайте ЭДС гальванического элемента.
36. К катоду AlïAl3+(10-3M),T=298K подберите анод, составьте схему Г.Э. из этих электродов и рассчитайте ЭДС элемента; напишите уравнения электродных процессов и токообразующей реакции.
37. Вычислите ЭДС гальванического элемента, составленного из двух электродов: СоïСо2+(0,01М) и CdïCd2+ (0,01M) при Т = 298К. Составьте схему Г.Э. из этих электродов. Напишите уравнения электродных процессов и токообразующей реакции.
38. В гальваническом элементе
(А) СоïСоSO4(0,1М)ïïSnCl2(Cx)÷Sn (K) при 250С Ег.э. = 0,077В. Определите С(SnCl2) у катода, напишите уравнения электродных пароцессов и токообразующей реакции. Сколько электронов принимает участие в окислительно-восстановительном процессе.
39. Концентрационный Г.Э. составлен из двух никелевых электродов, погруженных в растворы NiSO4 c концентрациями: С1(NiSO4) =0,1M, C2(NiSO4) = 0,0005M. Рассчитайте Ег.э. при 250С, напишите уравнения электродных процессов; составьте схему Г.Э.
40. Какая из токообразующих реакций (прямая или обратная) может быть осуществлена в Г.Э. при с.у.:
Mg + Zn2+ D Mg2+ + Zn
DGf, кДж/моль -147,2 -456
Cоставьте схему возможного Г.Э., рассчитайте Ег.э., напишите уравнения электродных процессов.
41. К аноду In÷In3+(0,02M), j0(In3+/In) =0,343B подберите катод. Составьте схему Г.Э. из этих электродов. Напишите уравнения катодного, анодного и токообразующих процессов в Г.Э. Рассчитайте Ег.э. при 298К.
42. К катоду Со÷Со3+(0,05М) = 0,46В подберите анод; составьте схему Г.Э. из этих электродов. Напишите уравнения электродных процессов и токообразующей реакции в полученном Г.Э. Рассчитайте Ег.э. при 298К.
43.При 298К вычислите ЭДС гальванического элемента, составленного из хромового электрода, погруженного в раствор CrCl3 c C(CrCl3) = 0,01M и никелевого электрода в 1М растворе NiCl2 , a(NiCl2) = 90%. Cоставьте схему Г.Э., напишите уравнения электродных процессов и токообразующей реакции. Сколько электронов принимает участие в суммарном процессе?
44. При Т=250С Ег.э. = 0,343В
(А) Со÷CoSO4 (Cx)êêHCl(0,01M)êH2, Pt (K).
Рассчитайте С(CoSO4); Напишите уравнения электродных процессов и токообразующей реакции. Сколько электронов принимает участие в токообразующей реакции и в каком направлении они движутся во внешней цепи.
45. Рассчитайте при 250С ЭДС концентрационного гальванического элемента, составленного из двух кислородных электродов в растворах серной кислоты с концентрациями С1(H2SO4) = 1M, a(H2SO4) =80% и С2(H2SO4) = 0,001M. Cоставьте схему Г.Э., напишите уравнения электродных процессов.
46. Вычислите ЭДС и изменение энергии Гиббса для гальванического элемента, образованного Mn и Zn, погруженными в растворы их солей с концентрациями ионов (моль/л):С(Mn2+) = 1,2×10-3 , C(Zn2+) = 0,25. Напишите уравнения электродных процессов и токообразующей реакции.
47. Ег.э. = 0,300В при 298К.
(А) Cr÷CrCl3(0,01M), a=95%)ï½Tl+(0,003M) ïTl(K).
Рассчитайте j0(Tl+/Tl). Напишите уравнения электродных процессов и токообразующей реакции. Сколько электронов принимает участие в суммарной реакции.
48. Токообразующая реакция в гальваническом элементе:
Cd + Cu2+ D Cd2+ + Cu
DGf, кДж/моль 65,04 -77,8
Рассчитайте ЭДС гальванического элемента, напишите уравнения электродных процессов. Нарисуйте схему гальванического элемента.
49. К оловянному аноду, погруженному в раствор с С(SnCl2) =10-3M подберите катод. Составьте схему Г.Э. из этих электродов. Напишите уравнения электродных процессов и токообразующей реакции. Рассчитайте ЭДС при 298К.
50. К цинковому аноду в растворе с С(ZnSO4) = 0,001M, a(ZnSO4) =95% подберите катод. Рассчитайте Ег.э. при 298К. Напишите уравнения электродных и токообразующего процессов.
51. ЭДС концентрационного гальванического элемента
(А)Pt,H2÷HCl(10,05M,a=92%)÷ïHCl(Cx, a=88%½H2,Pt (K)
равна 0,03В при 298К. Определите молярную концентрацию HCl и рН раствора HCl у катода. Напишите уравнения катодного и анодного процессов.
52. ЭДС гальванического элемента
(A) CuïCu(NO3)2(0,01M)ïïAg(NO3)(0,005M, a = x)ïAg (K)
равна 0,382 В при Т = 298К. Определите кажущуюся степень диссоциации 0,005М раствора AgNO3.Напишите уравнения электродных процессов и токообразующей реакции.
53. Составьте гальванический элемент из двух электродов AlïAl3+ (0,01M) и CuïCu+ (0,001M). Рассчитайте Ег.э. Напишите уравнения электродных процессов и токообразующей реакции.
54. К аноду, образованному погружением Fe- пластины в раствор с Сэк(FeCl2). = 0,2Н, a(FeCl2) = 0,88, подберите катод. Составьте схему Г.Э. из этих электродов. Рассчитайте Ег.э. и DGr при 298К.
55. К катоду PbïPbCl2 (C=10-4M, a =98%) подберите анод и составьте схему гальванического элемента. Рассчитайте ЭДС этого элемента, напишите уравнения электродных процессов и токообразующей реакции.
56. ЭДС гальванического элемента
(А)ZnïZnSO4(0,5M, a = 90%)ïïMo3+(10-3M) ïMo (K) равна 0,523В при Т = 298К. Вычислите j0(Мо3+/Мо); напишите уравнения электродных процессов и токообразующей реакции.
57. Суммарная реакция в Г.Э. описывается уравнением
Pb + 2Ag+ D Pb2+ + Ag0
DGf, кДж/моль 77,1 -24,32
Рассчитайте ЭДС гальванического элемента при Т = 250С, нарисуйте его схему и напишите уравнения электродных процессов.
58. Нарисуйте схему Г.Э., составленного из оловянного электрода в растворе с С(SnCl2) = 0,1M, a = (SnCl2) = 80% и свинцового электрода в растворе с С(Pb2+) =0,01M. Рассчитайте ЭДС этого элемента, напишите уравнения электродных процессов и токообразующей реакции.
59. Составьте схемы двух гальванических элементов, в одном из которых Ni в 0,01М растворе NiSO4 будет катодом, в другом – анодом. Напишите уравнения электродных процессов и вычислите ЭДС этих элементов при 298К.
60. Составьте схему, напишите уравнения электродных процессов, суммарной реакции и рассчитайте при 298К ЭДС элемента, у которого один электрод – кадмиевый с С(Cd2+) = 10-2 моль/л, второй – кислородный при рН = 1.
3. ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ МЕТАЛЛОВ И СПЛАВОВ И МЕТОДЫ ЗАЩИТЫ ОТ НЕЕ
3.1. ПРИЧИНЫ И УСЛОВИЯ ПРОТЕКАНИЯ КОРРОЗИИ
Электрохимическая коррозия – разрушение металлов и сплавов во влажных средах и электролитах с возникновением внутри металлов электрического тока.
Причинами электрохимической коррозии является энергетическая неоднородность поверхности металлов и сплавов, и наличие на ней пленки влаги. Это сочетание приводит к образованию на поверхности металлов и сплавов катодных и анодных участков, т.е. к образованию коррозионных микрогальванических элементов. При этом, как и в гальванических элементах jк >jа.
Условием протекания электрохимической коррозии является наличие двух сопряженных процессов:
а) анодного - переход металла с анодных участков поверхности в раствор в виде ионов:
Me - ze ® Mez+(окисление, коррозия) (36)
Эквивалентное количество электронов остается в металле и переходит к катодным участкам поверхности; потенциал анодного процесса определяется в первом приближении стандартным электродным потенциалом корродирующего металла:
jА = j 0(Меz+/Me) (37)
б) катодного - связывание электронов, образующихся в анодном процессе, каким-либо веществом - окислителем (Ох), находящимся во влаге или электролите:
Ox + Ze ® Red (восстановление) (38)
Процесс связывания электронов называется деполяризацией, а вещества окислители - деполяризаторами.
Деполяризация протекает на катодных участках поверхности.
Потенциал катодного процесса определяется потенциалом окислителя (деполяризатора):
jк = j(Ох) (39)
 2015-08-21
2015-08-21 3499
3499








