Уравнение Ван-дер-Ваальса позволяет построить теоретические изотермы реального газа и сравнить их с экспериментальными изотермами и с изотермами идеального газа. Приведя уравнение Ван-дер-Ваальса для одного моля газа к виду
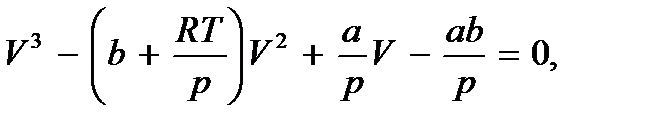
мы видим, что при заданных значениях T и p это уравнение есть уравнение третьей степени относительно V и поэтому имеет три корня (например, значения V 1, V 2, V 3). Семейство теоретических изотерм для некоторого реального газа представлено на рис. 7.3. В отличие от монотонно изменяющихся изотерм идеального газа, изотермы реального газа при низких температурах изображаются сложными кривыми, соответственно уравнению третьей степени. В той области значений коэффициентов, где уравнение имеет три действительных равных корня, ход изотерм становится монотонным. Совпадение изотерм идеального и реального газа наблюдается при малых давлениях и больших объемах. Так и должно быть, поскольку при указанных условиях газ можно считать идеальным. Для семейства изотерм Ван-дер-Ваальса характерно наличие так называемой критической изотермы (при температуре 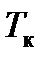 ), имеющей точку перегиба при некотором давлении
), имеющей точку перегиба при некотором давлении 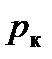 и объеме
и объеме 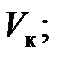 при
при 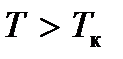 все изотермы идут монотонно, а при
все изотермы идут монотонно, а при 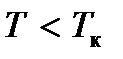 все изотермы имеют максимум и минимум.
все изотермы имеют максимум и минимум.
|
|
|
Экспериментальные изотермы, снятые при температуре выше критической, отражают монотонное увеличение давления газа при уменьшении его объема. При температурах ниже критической экспериментальная изотерма совпадает с теоретической изотермой Ван-дер-Ваальса правее точки а и приблизительно совпадает с теоретической левее точки e. Криволинейный участок abcde на экспериментальных изотермах отсутствует, т.е. при изотермическом сжатии газа его давление не изменяется. Вместо него наблюдается горизонтальный участок ae, причем, начиная с объема V 2, в цилиндре под поршнем находится и жидкость и газ, т.е. пар и жидкость равновесно сосуществуют друг с другом. Такой пар называют насыщенным. При значении объема 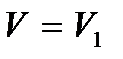 пар полностью конденсируется, переходя в жидкость, заполняющую весь объем, и при дальнейшем уменьшении объема изотермы описывают уже свойства реальной жидкости.
пар полностью конденсируется, переходя в жидкость, заполняющую весь объем, и при дальнейшем уменьшении объема изотермы описывают уже свойства реальной жидкости.
Состояния, соответствующие участку изотермы Ван-дер-Ваальса bcd, экспериментально не наблюдаются, так как здесь нарушалось бы первое условие устойчивого равновесия (6.25), поэтому эти состояния абсолютно неустойчивы и ни при каких условиях не могут быть осуществимы. При некоторых условиях удается на опыте получать состояния, соответствующие участкам ab и de изотерм Ван-дер-Ваальса. Например, если пар тщательно очистить от пыли и ионов, то можно наблюдать задержку конденсации, в результате которой удается его сжать до объема, меньшего, чем объем насыщенного пара, и соответственно до давления, большего, чем давление насыщенного пара при данной темпера-
|
|
|
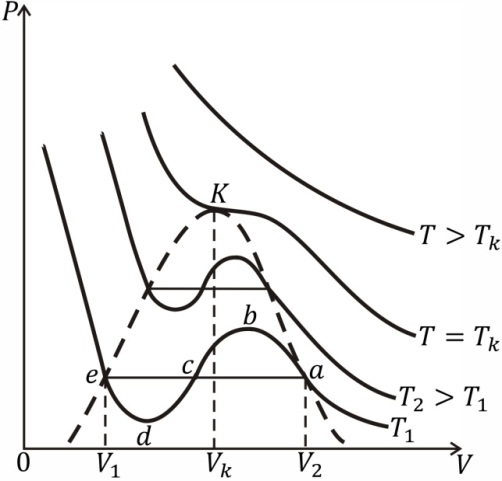 Рис. 7.3
Рис. 7.3
|
туре. Такой пар на-зывают пересыщенным паром. Состояния пересыщенного пара, соответствующие участку ab изотермы Ван-дер-Ваальса, не являются устойчивыми, т.е. являются метастабильными состояниями. Достаточно попасть в пересыщенный пар пылинке, капельке или заряженной частице, чтобы в нем возникла конденсация, сопровождающаяся скачкообразным падением давления до давления насыщенного пара. Подобным же образом при изотермическом увеличении объема сжатой жидкости можно наблюдать задержку в образовании паровой фазы, несмотря на то, что объем, занимаемый жидкостью, превышает ее молекулярный объем, а давление ниже, чем давление насыщенного пара при данной температуре. Такие состояния будут также метастабильными. Они соответствуют участку de изотермы Ван-дер-Ваальса и называются состояниями растянутой жидкости; их называют также состояниями перегретой жидкости (в том смысле, что при данном объеме и температуре часть жидкости должна была бы находиться в парообразном состоянии, в то время как на практике паровая фаза отсутствует).
С повышением температуры, как видно из рис. 7.3, горизонтальный участок изотерм Ван-дер-Ваальса сокращается, стягиваясь в точку при критической температуре 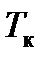 . Это значит, что объемы, а следовательно, и плотности жидкости и пара с повышением температуры сближаются между собой, пока не совпадут в критической точке. В критической точке исчезает всякое различие между жидкостью и паром, плотности жидкости и пара сравниваются, поэтому переход вещества из газообразного состояния в жидкое происходит непрерывно. Вблизи же критической точки резко возрастают флуктуации плотности, приводящие к сильному возрастанию рассеяния света, получившему название опалесценции. В критическом состоянии вещество обладает особыми свойствами. Так, в этом состоянии неограниченно большой оказывается сжимаемость вещества. Эта величина определяется производной
. Это значит, что объемы, а следовательно, и плотности жидкости и пара с повышением температуры сближаются между собой, пока не совпадут в критической точке. В критической точке исчезает всякое различие между жидкостью и паром, плотности жидкости и пара сравниваются, поэтому переход вещества из газообразного состояния в жидкое происходит непрерывно. Вблизи же критической точки резко возрастают флуктуации плотности, приводящие к сильному возрастанию рассеяния света, получившему название опалесценции. В критическом состоянии вещество обладает особыми свойствами. Так, в этом состоянии неограниченно большой оказывается сжимаемость вещества. Эта величина определяется производной 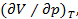 вычисляемой при постоянной температуре (это обстоятельство отмечено индексом T в обозначении производной). Сжимаемость характеризует способность вещества изменять свой объем при изотермическом изменении давления. При этом условии изменение объема, возникающее при изменении давления на dp, равно dV =
вычисляемой при постоянной температуре (это обстоятельство отмечено индексом T в обозначении производной). Сжимаемость характеризует способность вещества изменять свой объем при изотермическом изменении давления. При этом условии изменение объема, возникающее при изменении давления на dp, равно dV = 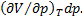 Неограниченное увеличение сжимаемости при приближении к критической точке определяется формой кривой, ограничивающей область двухфазных состояний на pV -диаграмме (пунктирная кривая на рис. 7.3). В критической точке К
Неограниченное увеличение сжимаемости при приближении к критической точке определяется формой кривой, ограничивающей область двухфазных состояний на pV -диаграмме (пунктирная кривая на рис. 7.3). В критической точке К
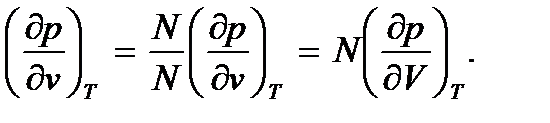
В этой цепочке равенств N – число частиц вещества, v – объем, приходящийся на одну частицу. Следовательно, в критическом состоянии 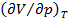
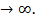
В критической точке обращается в бесконечность также коэффициент термического (теплового) расширения и теплоемкость 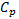 вещества. Коэффициентом термического расширения называ-
вещества. Коэффициентом термического расширения называ-
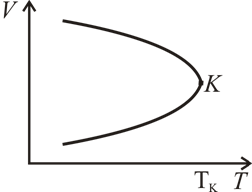 Рис. 7.4
Рис. 7.4
|
ют производную 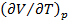 , вычисляемую при постоянном давлении. Эта производная характеризует способность вещества изменять свой объем при изобарическом изменении температуры. Именно если в таких условиях температура изменилась на dT, то изменение объема составит величину
, вычисляемую при постоянном давлении. Эта производная характеризует способность вещества изменять свой объем при изобарическом изменении температуры. Именно если в таких условиях температура изменилась на dT, то изменение объема составит величину
dV = 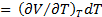 .
.
Обращение в бесконечность теплоемкости 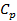 связано с неограниченным возрастанием
связано с неограниченным возрастанием 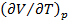 . Действительно, учитывая, что
. Действительно, учитывая, что
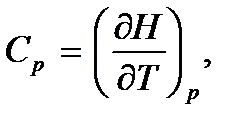
где H – тепловая функция (энтальпия), будем иметь
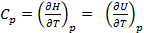 + p
+ p 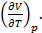
Далее
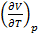 =
= 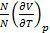 =
= 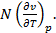
Стремление 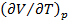 к бесконечности при
к бесконечности при 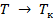 видно из рис. 7.4, на котором изображена VT -диаграмма для испарения- конденсации. На этом рисунке площадь, ограниченная кривой, есть область, соответствующая двухфазным состояниям, а К – критическая точка.
видно из рис. 7.4, на котором изображена VT -диаграмма для испарения- конденсации. На этом рисунке площадь, ограниченная кривой, есть область, соответствующая двухфазным состояниям, а К – критическая точка.
Наконец, в критическом состоянии исчезает поверхностное натяжение жидкости, поскольку жидкость становится неотличимой от пара.
|
|
|
Достижение критического состояния на практике определяют по исчезновению поверхности раздела фаз в двухфазной системе – жидкость и газ, образовавшийся в результате испарения некоторой части жидкости.
Критические параметры 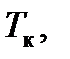
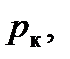
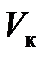 можно определить, учитывая, что критическая точка K является точкой перегиба и, следовательно, в этой точке первая и вторая производные давления по объему равны нулю. Дифференцируя функцию (7.1) (при постоянной температуре), будем иметь
можно определить, учитывая, что критическая точка K является точкой перегиба и, следовательно, в этой точке первая и вторая производные давления по объему равны нулю. Дифференцируя функцию (7.1) (при постоянной температуре), будем иметь
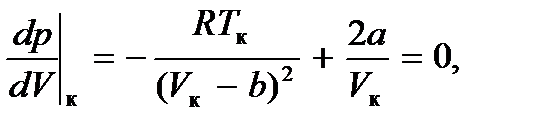
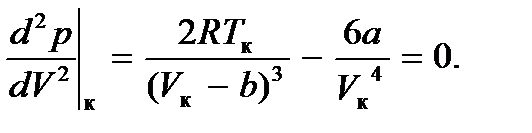
Решая эту систему, находим 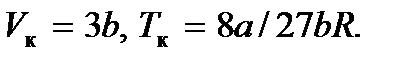 Подставив эти величины в уравнение (7.1), найдем и критическое давление:
Подставив эти величины в уравнение (7.1), найдем и критическое давление: 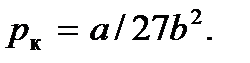
Отметим, что критическая точка может существовать не только у жидкости и пара, но и у других фаз. Она существует у таких фаз,
различие между которыми имеет лишь чисто количественный характер. Таковыми и являются жидкость и пар, отличающиеся друг от друга лишь большей или меньшей ролью межмолекулярного взаимодействия. Качественные же различия между ними во внутреннем строении гораздо менее значительны, чем между твердым телом и жидкостью и тем более между твердым телом и газом. Поэтому и существует область давлений и температур, где все свойства этих агрегатных состояний вещества окажутся близкими, и в какой-то точке совпадающими.
Если соединить между собой крайние точки горизонтальных участков экспериментальных изотерм, то получим дугообразную кривую (на рис. 7.3 показана пунктиром), ограничивающую область двухфазного состояния вещества. Эта кривая и участок изотермы, лежащий слева от критической точки K, делит всю площадь диаграммы pV на три области, соответствующие различным состояниям вещества. Область, ограниченная дугообразной кривой, соответствует двухфазному состоянию вещества; слева от нее расположена область, где устойчива жидкая фаза, а справа, где устойчиво парообразное состояние вещества. Область, расположенная выше критической точки (вверх и вправо от критической изотермы), соответствует только однофазным состояниям, т.е. состояниям, которые нельзя отнести ни к газу, ни к жидкости. Вещество непрерывным образом переходит как в жидкое, так и в газообразное состояние в соответствующих областях значений параметров p и V.
|
|
|
Отметим, что дугообразная кривая стягивается в точку в критической точке K. Следовательно, в критической точке все три действительных корня становятся равными друг другу и равными V к, а уравнение состояния приобретает вид 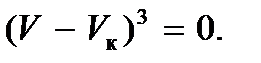
Таким образом, уравнение Ван-дер-Ваальса описывает свойства не только газов и паров, но и жидкостей. Анализ изотерм реального газа показывает, что превращение реального газа в жидкость возможно только при температурах, меньших критической, и при соответствующих давлениях.
 2015-09-06
2015-09-06 8159
8159
