В 1887 году шведский учёный С. Аррениус выдвинул гипотезу о том, что соли, кислоты и основания в воде диссоциируют на ионы ─ подвергаются электролитической диссоциации, механизм которой можно рассмотреть на примере диссоциации хлорида калия (рис. 4.4).
Рис. 4.4 ─ Схема процесса диссоциации хлорида калия
При растворении в воде полярные молекулы Н2О ориентируются противоположно заряженными концами к ионам калия и хлора, которые гидратиратируются и отщепляются от кристалла соли. Электролитическая диссоциация (разложение вещества на ионы) записывается без участия молекул воды:
KCl → K+ + Cl¯.
Положительно заряженные ионы называются катионами, отрицательно заряженные ─ анионами. Электролитическая диссоциация веществ с ковалентной полярной связью имеет предварительную стадию ионизации, когда под влиянием полярных молекул растворителя происходит увеличение полярности химической связи.
| Электролитическая диссоциация − это разложение вещества на ионы под действием полярных молекул растворителя. К электролитам относятся кислоты, основания, соли. |
Количественно электролитическая диссоциация характеризуется степенью и константой диссоциации. Степень электролитической диссоциации (α) равна отношениючисла молекул, которые продиссоциировали на ионы, к общему числу молекул электролита:
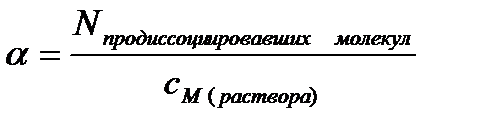
 2015-09-06
2015-09-06 592
592







