Тема 1.3. Классы неорганических соединений.
Основные классы неорганических соединений и их номенклатура
ОСНОВНЫЕ КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИИ
И ИХ НОМЕНКЛАТУРА
Изучив материал данной главы, студент должен уметь:
— охарактеризовать каждый из четырех классов неорганических веществ;
— отличать друг от друга основные, кислотные и амфотерные оксиды;
— по названию оксида записать его формулу и знать способы получения оксидов;
—дать определение понятий основания и кислоты в соответствии с номенклатурными правилами, составить их формулы и по формулам дать правильные названия;
— с помощью соответствующих реакций и индикаторов отличать основания и кислоты друг от друга;
— правильно называть важнейшие кислоты и их кислотные остатки;
— определять важнейшие химические свойства кислот;
— исходя из формул, составлять названия солей;
— в соответствии с названием правильно записывать формулы солей;
— охарактеризовать важнейшие способы получения солей, а также их химические свойства.
Химические соединения делятся на простые и сложные. К простым относятся металлы и неметаллы. Сложные вещества в неорганической химии делятся на четыре класса: оксиды,
основания, кислоты и соли.
Такая- классификация сложных веществ основана на том, что хотя всем соединениям одного класса присущи свои особенности, специфические свойства, однако имеется целый ряд сходных свойств, отличающих их от соединений других классов. Зная общие особенности класса соединений, можно охарактеризовать свойства отдельных его представителей, что значительно облегчает их изучение.
Способы получения солей
1. Взаимодействием металла с неметаллом:
Mg + CI2 = MgCI2
2. Взаимодействием металлов с кислотами:
 Zn -г 2НCI — Z nCI2 И- Н2
Zn -г 2НCI — Z nCI2 И- Н2
3. Взаимодействием металлов с солями:
Сu + НgCI2 — СuСI2 -Нg
4. Взаимодействием основных оксидов с кислотами:
СаО + 2НСI = СаСI2 + Н2O
5. Взаимодействием кислотных оксидов с основаниями:
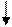 Са(ОН)2+ СО2 = СаСОз + Н2
Са(ОН)2+ СО2 = СаСОз + Н2
6. Взаимодействием кислот с Основаниями:
2NаОН + Н2 SО4 = Nа2SО4 + 2Н2О
7. Взаимодействием кислотных оксидов с солями:
 Na2СОз+ SO3= Na2SO4 + CO2
Na2СОз+ SO3= Na2SO4 + CO2
 8. Взаимодействием солей между собой:
8. Взаимодействием солей между собой:
AgNО3+ NaCI = AgCI +NaNO3
9. Взаимодействием соли с основанием:
 СuSО4 + 2NаОН = Сu(ОН)2 + Na2SО4
СuSО4 + 2NаОН = Сu(ОН)2 + Na2SО4
10. Взаимодействием соли с кислотой:
2NaCI+ H2SO4=Na2SO4 + 2HCI
Соли представляют собой твердые кристаллические вещества, имеющие довольно высокие температуры плавления. По своей растворимости в воде соли делятся на легкорастворимые (NaCI, КСI, СаСI2), труднорастворимые (РЬСI2, CaS, Ag2SO4) и практически нерастворимые (BaSO4, ВаСОз, CaSiO3).
Некоторые соли кислородсодержащих кислот подвергаются разложению при нагревании. Это свойство используют для получения отдельных оксидов.
В реакциях обмена между солью и основанием (или солью и кислотой) получаются кислые и средние соли. Так, если, на кислую соль подействовать основанием, то можно получить среднюю соль:
КHSO4+ KOH = K2SO4 + H2O
Наоборот, действуя кислотой на среднюю соль, можно получить кислую соль:
K2SO4+H2SO4 = 2KHSO4
Некоторые кислые соли при нагревании переходят в средние:
 Т°
Т°
Са (НСО3)2 = СаСОз+ С02 + Н2О
 2015-10-16
2015-10-16 1077
1077