В зависимости от рН среды меняется характер протекания окислительно-восстановительного процесса между одними и теми же регентами. Например, взаимодействие восстановителя сульфита натрия (Na2SO3) с окислителем перманганатом калия (KMnO4) в кислотной (рН<7), нейтральной (pH=7) и щелочной (pH>7) среде приводит к образованию различных продуктов реакций:
5Na2SO3 +2KMnO4+3H2SO4  2MnSO4+5Na2SO4+K2SO4 +3H2O (pH 7);
2MnSO4+5Na2SO4+K2SO4 +3H2O (pH 7); 
Na2SO3 + 2KMnO4 + H2O  3Na2SO4 + 2MnO2 + 2KOH (pH=7);
3Na2SO4 + 2MnO2 + 2KOH (pH=7);
Na2SO3 + 2KMnO4 + 2KOH 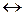 Na2SO4 + 2K2MnO4 + H2O (pH >7).
Na2SO4 + 2K2MnO4 + H2O (pH >7).
Получение различных продуктов обусловлено поляризующим действием протона (Н+), полярных молекул воды и гидроксид-аниона (ОН-). Максимальное поляризующее действие оказывает протон водорода, внедряясь в анион MnO4-, ослабляет связь между марганцем и кислородом, усиливая действие восстановителя.
Поляризующее влияние диполей воды слабее, чем у протона, а гидроксид-анионы, имея большой радиус иона и малый заряд, практически не оказывают поляризующего действия.
Влияние рН среды оказывает влияние и на направление окислительно-восстановительной реакции. Так, реакция
3J2 + 3H2O  6H+ + JO-3 + 5J-
6H+ + JO-3 + 5J-
в зависимости от характера среды может протекать как в прямом, так и в обратном направлении. Прибавление к раствору кислоты (понижение рН) вызывает увеличение концентрации ионов [Н+] и в соответствии с принципом Ле Шателье смещает равновесие в сторону обратной реакции. Прибавление щелочи (повышение рН) смещает равновесие в направлении прямой реакции.
 2015-10-22
2015-10-22 3199
3199
