Чтобы разобраться в связи температуры с внутренней энергией, повторим введенное ранее в механике понятие — число степеней свободы.
| Число степеней свободы механической системы — это минимальное число независимых скалярных величин, задание значений которых необходимо для однозначного определения конфигурации системы. |
В § 1.3 было показано, что давление газа численно равно импульсу, который передается за единицу времени единице площади стенки в результате ударов по ней молекул, поэтому давление определяется средней энергией только поступательного движения молекул.
Поступательное движение любой системы «как целого» полностью определяется движением одной единственной точки: её центра масс. В частности, полный импульс  любой нерелятивистской системы, равен произведению массы
любой нерелятивистской системы, равен произведению массы 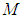 этой системы на скорость
этой системы на скорость  движения её центра масс. Энергия поступательного движения системы «как целого» равна
движения её центра масс. Энергия поступательного движения системы «как целого» равна 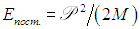 . Поэтому, для полного описания поступательного движения любой системы в трехмерном пространстве необходимо и достаточно задание значений трех координат центра масс. Таким образом, поступательному движению, как бы ни была устроена система, всегда соответствуют три поступательных степени свободы:
. Поэтому, для полного описания поступательного движения любой системы в трехмерном пространстве необходимо и достаточно задание значений трех координат центра масс. Таким образом, поступательному движению, как бы ни была устроена система, всегда соответствуют три поступательных степени свободы: 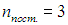 .
.
|
|
|
Можно сказать и так: «с точки зрения поступательного движения» любая система может быть точно, а не приближенно, представлена в виде одной единственной материальной точки совпадающей с центром масс системы и имеющей массу равную массе системы (рис. 1.15).

1. Основные понятия термодинамики.
В отличие от МКТ термодинамика изучает макроскопические свойства тел и явлений природы, не интересуясь их микроскопической картиной. Не вводя в рассмотрение атомы и молекулы, не входя в микроскопическое рассмотрение процессов, термодинамика позволяет делать целый ряд выводов относительно их протекания.
В основе термодинамики лежит несколько фундаментальных законов (называемых началами термодинамики), установленных на основании обобщения большой совокупности опытных фактов.
Подходя к рассмотрению изменений состояния вещества с различных точек зрения, термодинамика и МКТ взаимно дополняют друг друга, образуя по существу одно целое.
Термодинамика - раздел физики, изучающий общие свойства макроскопических систем, находящихся в состоянии термодинамического равновесия и процессы перехода между этими состояниями.
Термодинамический метод основан на введении понятия энергии и рассматривает процессы с энергетической точки зрения, т. е. основываясь на законе сохранения энергии и превращении её из одного вида в другой.
Термодинамическая система - совокупность тел, которые могут обмениваться энергией друг с другом и с внешней средой.
|
|
|
Для описания термодинамической системы вводятся физические величины, которые называются термодинамическими параметрами или параметрами состояния системы: р,V,T.
Физические величины, характеризующие состояние термодинамической системы, называются термодинамическими параметрами.
Давлением называется физическая величина, численно равная силе, действующей на единицу площади поверхности тела по направлению нормали к этой поверхности: 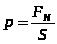 ,
, 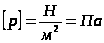 .
.
Нормальное атмосферное давление 1атм=105 Па.
Абсолютная температура - мера средней кинетической энергии молекул.
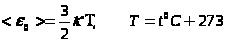 .
.
Состояния, в которых находится термодинамическая система, могут быть различными.
Если один из параметров в различных точках системы неодинаков и изменяется с течением времени, то такое состояние системы называется неравновесным.
Если все термодинамические параметры остаются постоянными во всех точках системы сколь угодно долго, то такое состояние называется равновесным, или состоянием термодинамического равновесия.
Любая замкнутая система по истечении определенного времени самопроизвольно переходит в равновесное состояние.
Всякое изменение состояния системы, связанное с изменением хотя бы одного из её параметров, называется термодинамическим процессом. Процесс, в котором каждое последующее состояние бесконечно мало отличается от предыдущего, т.е. представляет собой последовательность равновесных состояний, называется равновесным.
Очевидно, что все равновесные процессы протекают бесконечно медленно.
Равновесный процесс может быть проведен в обратном направлении, причем система будет проходить через те же состояния, что и при прямом ходе, но в обратной последовательности. Поэтому равновесные процессы называют обратимыми.
Процесс, при котором система после ряда изменений возвращается в исходное состояние, называется круговым процессом или циклом.
Все количественные выводы термодинамики строго применимы только к равновесным состояниям и обратимым процессам.
2. Число степеней свободы молекулы. Закон равномерного распределения энергии по степеням свободы.
Число степеней свободы – число независимых координат, полностью определяющих положение системы в пространстве. Молекулу одноатомного газа можно рассматривать как материальную точку, обладающую тремя степенями свободы поступательного движения.
Молекула двухатомного газа – совокупность двух материальных точек (атомов), жестко связанных недеформируемой связью; кроме трех степеней свободы поступательного движения имеет еще две степени свободы вращательного движения (рис. 1).
Трех- и многоатомные молекулы имеют 3+3=6 степеней свободы (рис. 1).
Естественно, что жесткой связи между атомами не существует. Поэтому для реальных молекул следует учитывать и степени свободы колебательного движения (кроме одноатомных).
К 
ак было показано, средняя кинетическая энергия поступательного движения молекулы равна
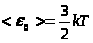 .
.
Поскольку каждая молекула всегда обладает тремя степенями свободы поступательного движения и не одна из этих степеней не имеет преимущества перед другими, на каждую степень свободы поступательного движения приходится энергия, равная
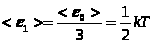 .
.
Т.к. движение молекул является хаотическим, то любое движение – поступательное и вращательное - является равновероятным. Из этого предположения следует один из важнейших законов статистической физики – закон Больцмана о равномерном распределении энергии по степеням свободы молекул: на каждую степень свободы поступательного и вращательного движения молекулы приходится в среднем одинаковая кинетическая энергия, равная  .
.
|
|
|
Для реальных молекул на каждую колебательную степень свободы приходится как кинетическая, так и потенциальная энергия.
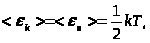 поэтому.
поэтому.
Таким образом, средняя кинетическая энергия молекулы
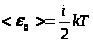 ,
,
где i – число степеней свободы молекулы.
3. Внутренняя энергия и работа газа при расширении.Iзаконтермодинамики.
Внутренняя энергия термодинамической системы - энергия движения и энергия взаимодействия микрочастиц системы (молекул, атомов, электронов, ядер и т.д.).
Т.к. потенциальная энергия молекул идеального газа равна нулю, внутренняя энергия идеального газа равна суммарной кинетической энергии всех его молекул:
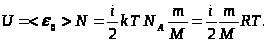
Изменениевнутреннейэнергии:
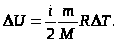
Внутреннюю энергию можно изменить 2-мя способами:
1) совершив работу;
2) при теплопередаче.
Теплопередачей называют совокупность процессов между молекулами вещества, приводящих к передаче энергии.
Изменение внутренней энергии системы при теплопередаче характеризуется количеством теплоты. Количество теплоты - мера изменения внутренней энергии при теплопередаче.
[Q]=Дж.
Р  абота и теплота связаны друг с другом. Опыты Джоуля и Роберта Майера показали, что работа и теплота переходят друг в друга в эквивалентных количествах. Однако теплота и работа неравноценны: работа может полностью перейти в теплоту, а теплота полностью перейти в работу не может. Причины этого объясняются началами термодинамики.
абота и теплота связаны друг с другом. Опыты Джоуля и Роберта Майера показали, что работа и теплота переходят друг в друга в эквивалентных количествах. Однако теплота и работа неравноценны: работа может полностью перейти в теплоту, а теплота полностью перейти в работу не может. Причины этого объясняются началами термодинамики.
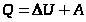 - I закон термодинамики
- I закон термодинамики
Количество теплоты, переданное системе, идет на увеличение её внутренней энергии и совершение системой работы против внешних сил (рис. 2).
Первое начало термодинамики подтверждается как теми опытами, на основании которых установлена эквивалентность между Q и A,так и совпадением выводов из него с наблюдаемыми фактами. Оно является выражением закона сохранения и превращения энергии.
Установление первого начала термодинамики позволило объяснить все неудачи, связанные с попыткой создания машины, которая могла бы совершать работу, не получая энергии извне (перпетууммобиле, или вечный двигатель первого рода). После формулировки первого закона термодинамики стало ясно, что если система не получает извне тепла или другой энергии, то Q=0 и DU=0, поэтому и A=0 Таким образом, создать вечный двигатель первого рода невозможно. Это утверждение является одной из формулировок первого начала термодинамики.
|
|
|
Работа, совершаемая системой при изменении объема, определяется следующим образом.
Пусть газ заключен в некотором цилиндре (рис. 3); найдем его работу при расширении.
Элементарная работа на пути
,
где F - сила, с которой газ давит на поршень.
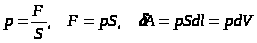 .
.
Работа, совершаемая системой при конечном изменении объёма от V1 до V2, находится интегрированием:
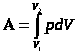
Произведенную при том или ином процессе работу можно изобразить графически с помощью кривой в координатах р, V.
П 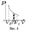 ри увеличении объёма на dV совершаемая газом работа
ри увеличении объёма на dV совершаемая газом работа 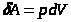 определяется заштрихованной площадью.
определяется заштрихованной площадью.
Поэтому полная работа, совершаемая при расширении от V1 до V2 определяется площадью, ограниченной осью абсцисс, кривой 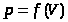 и прямыми
и прямыми 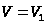 и
и 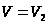 .
.
При p=const
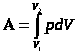 = p(V2-V1)=pDV
= p(V2-V1)=pDV
4. Теплоемкость
Первые экспериментальные измерения теплоты были выполнены в 1750 - 1751 г. в Петербурге Г.В. Рихманом. Им было установлено, что количество теплоты Q, переданное телу или отнятое у него, прямо пропорционально его массе и изменению температуры:
 .
.
Коэффициент пропорциональности получил название удельной теплоёмкости.
.
Удельной теплоемкостьювещества называется физическая величина, равная количеству теплоты, необходимому для нагревания единицы массы вещества на один градус.
Теплоёмкостью какого-либо тела называется величина, равная количеству теплоты, необходимой для нагревания этого тела на один градус.
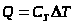 ,
, 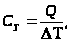
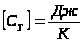 .
.
Молярной теплоёмкостью вещества называется величина, равная количеству теплоты, необходимому для нагревания 1 моля вещества на 1 градус.
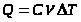 , C=
, C= 
Поскольку
или 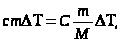
, 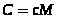 .
.
Величина теплоёмкости зависит от условий нагревания.
Различают теплоёмкости при постоянном объёме и при постоянном давлении:
сVи CV при V=const
сp и Cpпри p=const
Найдём связь CV и Cp
При 
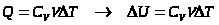
Т. к. 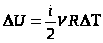 ,
, 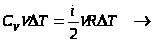
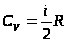
При 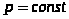
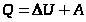
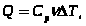
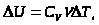


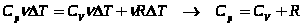 - уравнениеМайера
- уравнениеМайера
Поскольку CV=,
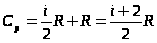
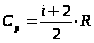
Величина
представляет собой характерную для каждого газа величину, которая зависит от числа атомов в молекуле газа.
Для одноатомного газа i = 3 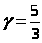 ,
,
для двухатомного i = 5 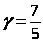 ,
,
для многоатомного i = 6  .
.
Число степеней свободы молекулы. Закон равномерного распределения энергии по степеням свободы молекул
Важной характеристикой термодинамической системы является ее внутренняя энергия U — энергия хаотического (теплового) движения микрочастиц системы (молекул, атомов, электронов, ядер и т. д.) и энергия взаимодействия этих частиц. Из этого определения следует, что к внутренней энергии не относятся кинетическая энергия движения системы как целого и потенциальная энергия системы во внешних полях.
Внутренняя энергия — однозначная функция термодинамического состояния системы, т. е. в каждом состоянии система обладает вполне определенной внутренней энергией (она не зависит от того, как система пришла в данное состояние). Это
означает, что при переходе системы из одного состояния в другое изменение внутренней энергии определяется только разностью значений внутренней энергии этих состояний и не зависит от пути перехода. В § 1 было введено понятие числа степеней свободы — числа независимых переменных (координат), полностью определяющих положение системы в пространстве. В ряде задач молекулу одноатомного газа (рис. 77, а) рассматривают как материальную точку, которой приписывают три
степени свободы поступательного движения. При этом энергию вращательного движения можно не учитывать (r—>0, J= mr2®0, T вр =Jw2/2®0).
В классической механике молекула двухатомного газа в первом приближении рассматривается как совокупность двух материальных точек, жестко связанных недеформируемой связью (рис. 77,б). Эта система кроме трех степеней свободы поступательного движения имеет еще две степени свободы вращательного движения. Вращение вокруг третьей оси (оси, проходящей через оба атома) лишено смысла. Таким образом, двухатомный газ обладает пятью степенями свободы (i=5). Трехатомная (рис. 77,0) и многоатомная нелинейные молекулы имеют шесть степеней свободы: три поступательных и три вращательных. Естественно, что жесткой связи между атомами не существует. Поэтому для реальных молекул необходимо учитывать также степени свободы колебательного движения.
В классической статистической физике выводится закон Больцмана о равномерном распределении энергии по степеням свободы молекул: для статистической системы, находящейся в состоянии термодинамического равновесия, на каждую поступательную и вращательную степени свободы приходится в среднем кинетическая энергия, равная kT/2, а на каждую колебательную степень свободы — в среднем энергия, равная kT. Колебательная степень «обладает» вдвое большей энергией потому, что на нее приходится не только кинетическая энергия (как в случае поступательного и вращательного движений), но и потенциальная, причем средние значения кинетической и потенциальной энергий одинаковы. Таким образом, средняя энергия молекулы
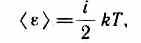
где i — сумма числа поступательных, числа вращательных и удвоенного числа колебательных степеней свободы молекулы:
i =i пост+ i вращ+2 i колеб.
В классической теории рассматривают молекулы с жесткой связью между атомами; для них i совпадает с числом степеней свободы молекулы.
Так как в идеальном газе взаимная потенциальная энергия молекул равна нулю (молекулы между собой не взаимодействуют), то внутренняя энергия, отнесенная к одному молю газа, будет равна сумме кинетических энергий NA молекул:
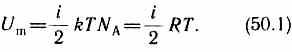
Внутренняя энергия для произвольной массы т газа
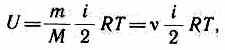
где М — молярная масса, v — количество вещества.
Теплоёмкость тела характеризуется количеством теплоты, необходимой для нагревания этого тела на один градус:
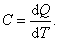
| (4.2.1) |
Размерность теплоемкости: [ C ] = Дж/К.
Однако, теплоёмкость – величина неопределённая, поэтому пользуются понятиями удельной и молярной теплоёмкости.
Удельная теплоёмкость (Суд) есть количество теплоты, необходимое для нагревания единицы массы вещества на 1 градус [ Cуд ] = Дж/К.
Для газов удобно пользоваться молярной теплоемкостью Cμ - количество теплоты, необходимое для нагревания 1 моля газа на 1 градус:
| (4.2.2) |
[Cμ] = Дж/(моль×К).
Из п. 1.2 известно, что молярная масса – масса одного моля:
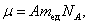
|
где А – атомная масса; mед - атомная единица массы; NА - число Авогадро; моль μ – количество вещества, в котором содержится число молекул, равное числу атомов в 12 г изотопа углерода 12С.
Теплоёмкость термодинамической системы зависит от того, как изменяется состояние системы при нагревании.
Если газ нагревать при постоянном объёме, то всё подводимое тепло идёт на нагревание газа, то есть изменение его внутренней энергии. Теплоёмкость при этом обозначается СV.
СР – теплоемкость при постоянном давлении. Если нагревать газ при постоянном давлении Р в сосуде с поршнем, то поршень поднимется на некоторую высоту h, то есть газ совершит работу (рис. 4.2).
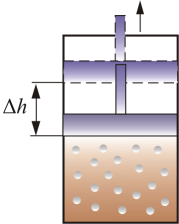
Рис. 4.2
Следовательно, проводимое тепло затрачивается и на нагревание и на совершение работы. Отсюда ясно, что 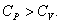 .
.
Итак, проводимое тепло и теплоёмкость зависят от того, каким путём осуществляется передача тепла. Значит, Q и С не являются функциями состояния.
Величины СР и СV оказываются связанными простыми соотношениями. Найдём их.
Пусть мы нагреваем один моль идеального газа при постоянном объёме(d A = 0). Тогда первое начало термодинамики запишем в виде:
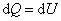 , ,
| (4.2.3) |
т.е. бесконечно малое приращение количества теплоты 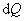 равно приращению внутренней энергии d U.
равно приращению внутренней энергии d U.
Теплоемкость при постоянном объёме будет равна:
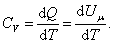 , ,
| (4.2.4) |
В общем случае
 , ,
|
так как U может зависеть не только от температуры. Но в случае идеального газа справедлива формула (4.2.4).
Из (4.2.4) следует, что 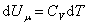
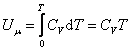 , ,
|
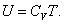 , ,
| (4.2.5) |
Внутренняя энергия идеального газа является только функцией температуры (и не зависит от V, Р и тому подобных), поэтому формула (4.2.5) справедлива для любого процесса.
Для произвольной идеальной массы газа:
 , ,
| (4.2.6) |
При изобарическом процессе, кроме увеличения внутренней энергии, происходит совершение работы газом:
 . .
|
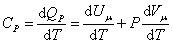 . .
| (4.2.7) |
Из основного уравнения молекулярно-кинетической теории 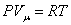 . При изобарическом процессе Р = const. Следовательно, из (4.2.7) получим:
. При изобарическом процессе Р = const. Следовательно, из (4.2.7) получим:
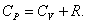 . .
| (4.2.8) |
Это уравнение Майера для одного моля газа.
Из этого следует, что физический смысл универсальной газовой постоянной в том, что R – численно равна работе, совершаемой одним молем газа при нагревании на один градус в изобарическом процессе.
Используя это соотношение, Роберт Майер в 1842 г. вычислил механический эквивалент теплоты: 1 кал = 4,19 Дж.
Полезно знать формулу Майера для удельных теплоёмкостей:
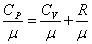 . .
|
или
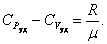 . .
| (4.2.9) |
Внутренняя энергия
Любая термодинамическая система состоит из атомов и молекул, находящихся в непрерывном движении. Количественной характеристикой движения является энергия.
Внутренняя энергия (U) характеризует общий запас энергии системы. Она включает все виды движения и взаимодействия частиц, составляющих систему: кинетическую энергию молекулярного движения, межмолекулярную энергию притяжения и отталкивания частиц, внутримолекулярную или химическую энергию, энергию электронного возбуждения, внутриядерную и лучистую энергию.
Величина внутренней энергии зависит от природы вещества, его массы и параметров состояния системы.
Определение полного запаса внутренней энергии вещества невозможно, т.к. нельзя перевести систему в состояние, лишенное внутренней энергии. Поэтому в термодинамике рассматривают изменение внутренней энергии (∆U), которое представляет собой разность величин внутренней энергии системы в конечном и начальном состояниях:
∆U = Ukoh. – Uнач.
Бесконечно малое изменение внутренней энергии обозначают через du т.к. внутренняя энергия является функцией состояния и ее изменение не зависит от пути процесса, а определяется только начальным и конечным состоянием системы, то du будет полным дифференциалом. Величины ∆U и du считают положительными, если внутренняя энергия при протекании процесса возрастает, а отрицательными если убывает.
Теплота и работа
Передача энергии от системы к окружающей среде и наоборот осуществляется в виде теплоты (Q) и работы (А).
| Система | ||||||||
| 
|  
| ||||||
| -Q | +Q | +А | -А | |||||
| Окружающая среда | ||||||||
Форма передачи энергии от одной части системы к другой вследствие неупорядоченного движения молекул, зависящая лишь от температуры частей системы и не связанная с перекосом вещества в системе называется теплотой.
Теплота связана с процессом, а не с состоянием системы, т.е. теплота является функцией состояния она зависит от пути процесса поэтому бесконечно малое количество теплоты обозначается δQ и не является полным дифференциалом. Теплота, подводимая к системе, считается положительной, а отданная ею - отрицательной.
Работа процесса - это энергия, передаваемая одним телом другому при их взаимодействии, не зависящая от температуры этих тел и не связанная с переносом вещества от одного тела к другому.
Работа, как и теплота, связана с процессом и не является свойством системы, т.е. функцией состояния. Paбoту, совершаемую системой против внешних сил.принято считать положительной, а совершаемую над системой - отрицательной.
 2017-12-14
2017-12-14 11880
11880
