МОЛЕКУЛЯРНАЯ ФИЗИКА И ТЕРМОДИНАМИКА


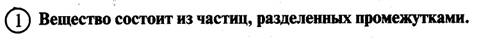
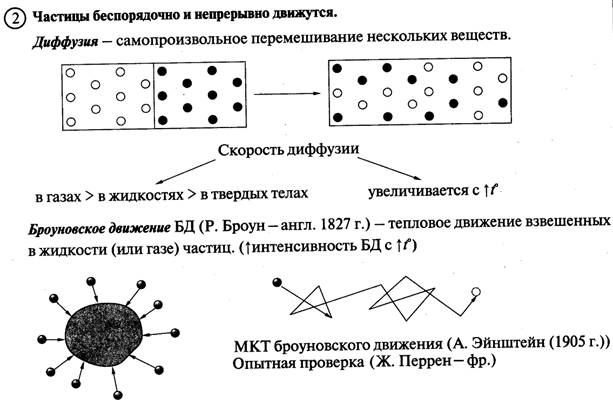
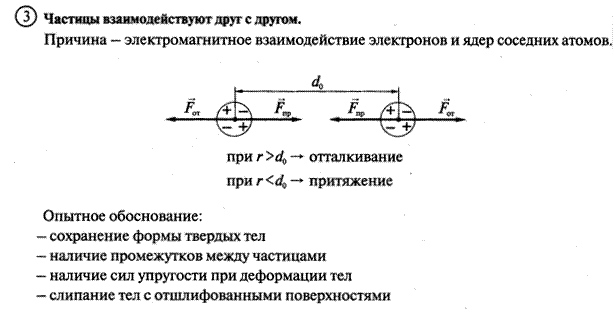

Основные понятия МКТ:
Относительная молекулярная масса вещества М r – это физическая величина, численно равная
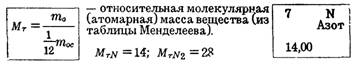

где Аr 1, Аr 2, …, Аrn – относительные атомные массы;
N 1, N 2, …, Nn – число атомов в формуле вещества.
Количество вещества n – это физическая величина, пропорциональная числу частиц N (атомов, молекул, …), из которых состоит вещество
n ~ N; 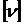 = 1 моль.
= 1 моль.
Число частиц, содержащихся в 1 моле, для различных веществ постоянно и равно
 - постоянная Авогадро.
- постоянная Авогадро.
Следовательно,
 ,
,
где N – общее число молекул в данной системе;
NА - постоянная Авогадро.
Молярная масса в-ва m – это физическая величина, численно равная массе 1 моля вещества
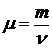 ; [ m ] = 1 кг/моль.
; [ m ] = 1 кг/моль.
Масса молекулы в-ва m 0 – это физическая величина, численно равная отношению массы вещества к числу частиц, из которых состоит вещество
 ; [ m 0] = 1 кг.
; [ m 0] = 1 кг.
Плотность в-ва r – это физическая величина, численно равная отношению массы вещества к объёму, который занимает вещество
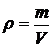 ; [ r ] = 1 кг/м3.
; [ r ] = 1 кг/м3.
Концентрация в-ва n – это физическая величина, численно равная отношению числа частиц, из которых состоит вещество, к объёму, который занимает вещество
 ; [ n ] = 1 м–3.
; [ n ] = 1 м–3.
Молекулярная физика и термодинамика – разделы физики, в которых изучаются макроскопические процессы в телах, связанные с огромным числом микрочастиц, содержащихся в телах.
Для изучения этих процессов применяют два принципиально различающихся (но взаимно дополняющих друг друга) метода:
1) статистический (молекулярно-кинетический) – изучает поведение систем из большого числа частиц, анализируя движения отдельных частиц на основе законов классической механики, с последующим усреднением их характеристик и вычислением наблюдаемых величин, относящихся ко всей системе, с использованием теории вероятностей и методов математической статистик.
2) термодинамический (феноменологический) − изучает наиболее общие свойства макросистем (без учёта внутреннего строения) и процессы, сопровождающиеся превращениями энергии, на основе фундаментальных принципов (начал), которые являются обобщением многочисленных наблюдений.
Þ
Состояние системы
| Макросостояние системы | Микросостояние системы |
| Т (температура), Р (давление), V (объем), ν (количество вещества), | координатами скоростями молекул |
Одному макросостоянию соответствует множество микросостояний.
Идеальный газ – это модель реального газа, обладающая следующими свойствами:
1) собственный объём молекул пренебрежимо мал по сравнению с размером сосуда;
2) между молекулами газа отсутствует взаимодействие;
3) столкновения молекул газа между собой и со стенками сосуда абсолютно упругие.

Уравнение, связывающее термодинамические параметры, называется уравнением состояния газа (уравнение Менделеева-Клапейрона)
 ,
,
где p – давление газа; V – объем газа; m – масса газа; µ – молярная масса газа; ν – количество вещества; R = 8,31 Дж/(моль∙К) – универсальная газовая постоянная.
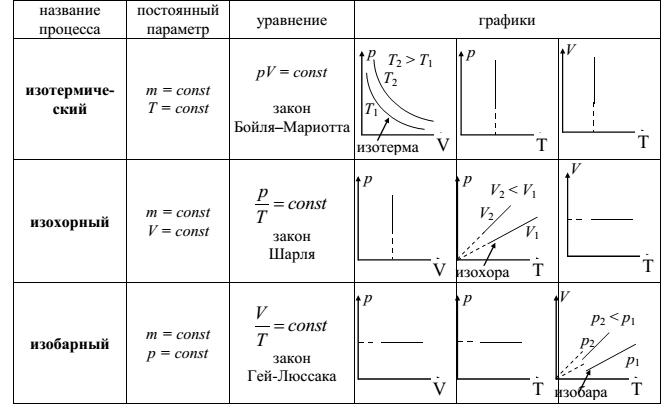
Термодинамический процесс – это процесс изменения состояния термодинамической системы, то есть изменение параметров состояния (p, V, T).
Изопроцесс – это процесс, при котором один из термодинамических параметров, характеризующих состояние данной массы газа ( , остаётся постоянным.
, остаётся постоянным.

ТД
 2017-12-14
2017-12-14 1709
1709