Гальванічні елементи
Спеціальні пристрої, в яких на електродах відбуваються cамодовільні окисно-відновні процеси і які створюють різницю потенціалів, а отже можливість напрямленого переміщення електронів від одного електрода (негативного) до другого (позитивного), тобто електричний струм, називають хімічними джерелами струму (ХДС). При цьому хімічна енергія окисно-відновної реакції перетворюється на електричну. До таких пристроїв відносять гальванічні та паливні елементи, акумулятори.
Гальванічний елемент складається із двох електродів – анода і катода, занурених у розчин або розплав електроліту, електролітичного ключа (сольовий місток) і зовнішньої схеми (металічні провідники та вимірювач напруги чи сили струму).
У гальванічних елементах окисно-відновні реакції протікають на поверхні електродів. Процеси окиснення і відновлення просторово розділені. Окиснення протікає на аноді, відновлення – на катоді. У гальванічному елементі анодом є електрод, потенціал якого менший, ніж потенціал катода. Анод має заряд "–", катод – заряд "+".
Максимальну напругу гальванічного елемента, яка відповідає оборотному процесу окисно – відновної реакції на його електродах, називають електрорушійною силою – Е (ЕРС) елемента. Якщо реакція здійснюється за стандартних умов, тобто якщо всі речовини, які беруть участь у реакції, перебувають у своїх стандартних станах, то ЕРС, що досягається, називають стандартною ЕРС цього елемента. ЕРС гальванічного елементу обчислюють як різницю між потенціалами катода 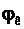 і анода
і анода 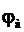 :
:
 . (4.6)
. (4.6)
Прикладом гальванічного елемента є мідно-цинковий елемент Даніеля-Якобі, що складається із цинкової та мідної пластинок, занурених у розчини сульфатів цинку та купруму (ІІ) з молярними концентраціями 1 моль/л (рис. 15).
Цинковий електрод – анод, на якому проходить реакція окиснення: Zn0 = Zn2+ + 2ē.
Мідний електрод – катод, на якому проходить реакція відновлення: Cu2+ + 2ē = Cu0
Сумарне рівняння процесу в йонному вигляді:
Zn0 + Cu2+ = Cu0 + Zn2+,
або в молекулярній формі: Zn + CuSO4 = Cu + ZnSO4.
Схематичний запис гальванічного елемента виглядає таким чином: (–) Zn| ZnSO4 || CuSO4| Cu (+).
За стандартних умов ЕРС гальванічного елемента (додаток 8):
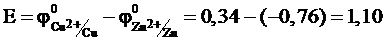 В.
В.
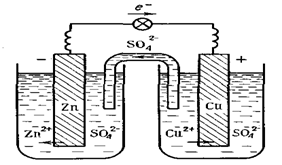
Рис. 15. Схема гальванічного елемента Даніеля-Якобі
Концентраційні елементи – хімічні джерела струму, побудовані з однакових електродів, занурених у розчини одного і того самого електроліта, що різниться лише концентрацією. Наприклад:
(–) Cu| CuSO4 || CuSO4| Cu (+).
0,001моль/л 0,1моль/л
Катодом таких елементів буде електрод, занурений в електроліт з більшою концентрацією, а анодом – електрод, занурений в електроліт з меншою концентрацією.
Поляризація – це зміна величини електродного потенціалу катода чи анода через зміну стану поверхні електрода – утворення нерозчинних солей, оксидних і газових плівок, які виникають на поверхні електрода при роботі гальванічного елемента. Наприклад, для гальванічного елементу: Zn | H2SO4 | Cu на катоді відбувається процес: 2H+ + 2ē → H2↑.
Хімічна поляризація в цьому випадку обумовлена утворенням газової плівки водню, що ізолює поверхню катода від розчину електроліту, внаслідок чого зменшується ЕРС.
Концентраційна поляризація електродіввиникає за рахунок зміни концентрації йонів у поверхневому шарі електрода, що впливає на величину потенціалу електрода. Наприклад, при роботі мідно-цинкового гальванічного елемента (Zn │ZnSO4 ║СuSO4 │ Cu) зростає концентрація йонівZn2+ біля анода і зменшується концентрація йонів Сu2+ біля катода, що призводить до зближення потенціалів катода і анода, тобто до зменшення ЕРС. Усунення або зниження поляризації називається деполяризацією. Концентраційна поляризація зменшується за рахунок перемішуванням електроліту, а хімічна –введенням деполяризаторів.
Акумулятори
Гальванічні елементи оборотної та багаторазової дії називають акумуляторами. Дані пристрої здатні при розряджанні перетворювати накопичену хімічну енергію на електричну (як гальванічний елемент), а при заряджанні електричну – на хімічну (як електролізер). Найбільше застосування мають свинцевий (кислотний) та лужні акумулятори. Пластини свинцевого акумулятора виготовляють: анодні – зі свинцю, а катодні – з комірчастих відливок хартблею – сплаву свинцю зі стибієм. У комірки катода запресовують пластичну суміш плюмбум (ІV) оксиду із гліцерином, яка здатна тверднути, утворюючи гліцерат плюмбуму (ІV). Готові пластини збирають у батареї і занурюють у розчин електроліту з масовою часткою сульфатної кислоти 35 %. Розглянемо принцип дії свинцевого акумулятора (рис. 16), схема якого: Рb | Н2SO4 | PbO2 .
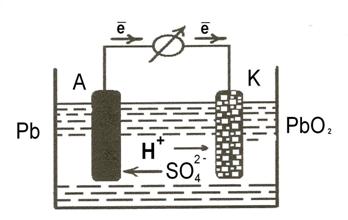
Рис.16. Схема свинцевого акумулятора
Під час розряджання акумулятора на електродах відбуваються такі електрохімічні процеси:
На аноді (–): Pb + SO 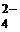 → PbSO4 +2ē;
→ PbSO4 +2ē;  0 = 0,36 В.
0 = 0,36 В.
На катоді (+): РbО2 + 4Н+ + SO  + 2ē → PbSO4 + 2Н2О;
+ 2ē → PbSO4 + 2Н2О;  0= 1,68 В.
0= 1,68 В.
Під час заряджання, коли через акумулятор пропускають постійний електричний струм, на електродах відбуваються протилежні процеси:
На катоді (–): PbSO4 + 2ē→ Pb + SO 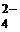 .
.
На аноді (+): PbSO4 + 2Н2О → РbО2 + 4Н+ + SO 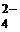 + 2ē.
+ 2ē.
Загальне рівняння реакції роботи свинцевого акумулятора має вигляд: Pb + 2H2SO4 + РbO2  2PbSO4 + 2H2O.
2PbSO4 + 2H2O.
Pb + 2H2SO4 + РbO2 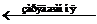 2PbSO4 + 2H2O
2PbSO4 + 2H2O
ЕРС акумулятора  = 1,68 – (– 0,36) = 2,04 В.
= 1,68 – (– 0,36) = 2,04 В.
Різниця потенціалів зарядженого акумулятора дорівнює 2,04 В; якщо вона знижується до 1,7 В, то це свідчить, що акумулятор треба заряджати. Під час експлуатації (роботи, розряджання) акумулятора густина електроліту (розчину Н2SO4) знижується, тоді як під час заряджання його, навпаки, – зростає. Перевагами свинцевих акумуляторів є: стабільність у роботі, велика електрична ємність, велика кількість циклів розряджання-заряджання та термін зберігання (до 2 років), а недоліками – великі маса й розміри, отже, мала питома ємність, виділення водню під час розряджання та негерметичність у процесі використання агресивного електроліту. Дещо кращими є лужні акумулятори, наприклад, нікель-кадмієві, нікель-залізні, срібно-цинкові тощо.
У нікель-залізному акумуляторі отвори залізних пластинок заповнені Ni2O3 × H2O (або Ni(OH)3) у суміші з порошком графіту та порошком відновленого заліза. Заряджання й розряджання лужного нікель-залізного акумулятора відбувається за схемою:
Fe + 2Ni(OH)3  Fe(OH)2 + 2Ni(OH)2;
Fe(OH)2 + 2Ni(OH)2;
Fe + 2Ni(OH)3 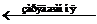 Fe(OH)2 + 2Ni(OH)2.
Fe(OH)2 + 2Ni(OH)2.
Напруга цього акумулятора при розряджанні становить близько 1,3 В.
Паливні елементи
У паливних елементах електричний струм виникає в результаті хімічної взаємодії горючих речовин з окисниками, які безперервно подаються ззовні до електродів, а продукти реакції безперервно відводяться. Роль активних матеріалів негативного електрода (анода) відіграють звичайні види палива (горючі речовини): водень, бензин, природний газ, карбон (ІІ) оксид, кокс, метанол тощо). Активним матеріалом катода паливного елемента може бути: кисень повітря, або чистий кисень, хлор.
Прикладом може бути воднево-кисневий елемент, який складається із дрібнопористих вугільних або нікелевих електродів, занурених у лужний розчин електроліту:
А (–) (Ni) H2 | KOH |O2 (Ni) (+) K
А: 2Н2 + 4ОН– = 4Н2О + 4ē.
К: О2 + 2Н2О + 4ē = 4OH– .
Водень дифундує крізь пористий електрод із каталізаторами (Pt, Pd), кисень – крізь другий електрод зі змішаними каталізаторами (Co і Аl або Fe, Mn і Ag). Воднево-кисневі елементи генерують струм 500-700 мА на 1 см2 активної поверхні електродів при напрузі близько 1 В та ККД (коефіцієнт корисної дії) 60-70 %.
 2017-12-14
2017-12-14 1100
1100








