Описание состояний атомов и молекул с помощью уравнения Шре-дингера является достаточно сложной задачей. Наиболее просто она решается для одного электрона, находящегося в поле ядра. Такие системы соответствуют атому водорода и водородоподобным ионам (однократно ионизированный атом гелия, двукратно ионизированный атом лития и т.п.). Однако и в этом случае решение задачи выходит за рамки нашего курса, поэтому ограничимся лишь качественным изложением вопроса.
Прежде всего в уравнение Шредингера (28.13) следует подставить потенциальную энергию, которая для двух взаимодействующих точечных зарядов - е (электрон) и Ze (ядро), - находящихся на расстоянии r в вакууме, выражается следующим образом:
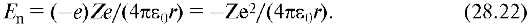
При центральной симметрии поля, созданного ядром, удобнее решать задачу не в декартовых прямоугольных координатах, а в сферических r, θ и р.
Решение уравнения Шредингера находят в виде произведения трех функций, каждая из которых зависит от одной переменной:
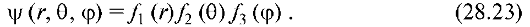
Аналогично тому, как для электрона в прямоугольной потенциальной яме с бесконечно высокими стенками граничные условия привели к конкретным возможным значениям ψ и энергии, так и в потенциальной яме, соответствующей атому водорода, физические условия приводят к возможным значениям f1, f2, f3 и, следовательно, ψ-функции. Здесь также проявляется главная особенность квантово-механических систем - дискретность состояний.
Дискретность математически заключается в том, что любая из функций уравнения (28.23) имеет целый набор (спектр) решений, каждому из которых отвечает определенное квантовое число. В отличие от прямоугольной потенциальной ямы с бесконечно высокими стенками состояние электрона в атоме характеризуется не одним, а несколькими квантовыми числа-ми1. Первое из них - главное квантовое число п - 1, 2, 3... Оно определяет уровни энергии электрона по закону:
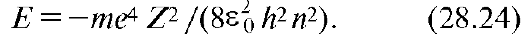

Это выражение является решением уравнения Шредингера и полностью совпадает с соответствующей формулой теории Бора (см. 28.7).
На рис. 28.11 показаны уровни возможных значений полной энергии атома водорода (Е1, Е2, Е3 и т.д.) и график зависимости потенциальной энергии ЕПот расстояния r между электроном и ядром [см. (28.22)]. С возрастанием главного квантового числа п увеличивается r [см., например, (28.33)], а полная [см. (28.24)] и потенциальная энергии стремятся к нулю. Кинетическая энергия также стремится к нулю. Заштрихованная область (Е >0) соответствует состоянию свободного электрона.
1 В общем случае квантовыми числами называют целые (0, 1, 2...) или полуцелые (1/2, 3/2, 5/2...) числа, определяющие возможные дискретные значения физических величин, которые характеризуют квантовые системы и элементарные частицы.

1 Наличие спина у частиц не следует из уравнения Шредингера.
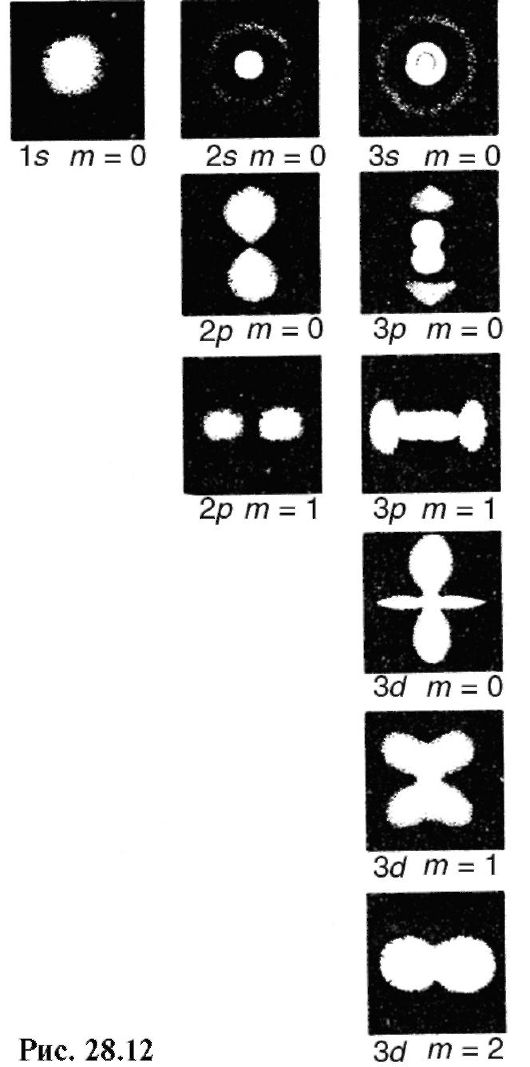
с этим расчетом: больше времени она находилась в местах с большей плотностью вероятности, менее длительно - в местах с меньшей плотностью вероятности. В результате экспозиции на фотопленке получились места разной интенсивности, которые иллюстрируют распределение электрона в атоме. Из рисунков видно, сколь условно и даже неверно понятие «орбита» применительно к движению электрона.
Спиновый и орбитальный магнитные моменты взаимодействуют между собой, это изменяет систему энергетических уровней атома по сравнению с той, которая была бы без такого взаимодействия. Говорят, что спин-орбитальное взаимодействие приводит к тонкой структуре энергетических уровней. Если оно существенно, то необходимо учитывать полный момент импульса электрона - орбитальный плюс спиновый. При этом вместо ml и ms используют другие квантовые числа: j и nij.
Квантовое число j - орбитальное плюс спиновое - определяет дискретные значения полного момента импульса L электрона:

Магнитное квантовое число m} характеризует возможные проекции полного момента импульса на некоторое произвольно выбранное направление Z:

При заданном l квантовое число j принимает два значения: ±1/2
(табл. 28.1).
Таблица 28.1
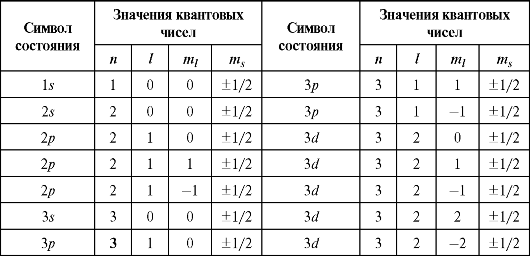
При заданном j квантовое число nij принимает 2j + 1 значений: -j, -j + 1... + j.
 2017-12-14
2017-12-14 2540
2540
