AgNO3  Ag+ + NO3– Ag+ + NO3– | |||
| jо | К (–): Ag+, H2O 0.8 > –0.41 | jо | А (+): (Ag) NO3–, H2O 0.8 < 2.0 > 1.23 |
| Ag+ + 1ē → Ag | Ag – 1ē → Ag+ |
Законы электролиза
Количественная сторона электролиза описывается законами Фарадея.
| I закон Фарадея | Масса вещества, выделившегося на электроде при электролизе, прямо пропорциональна количеству прошедшего через раствор электричества. |
m = К×Q
где m – количество вещества (г),
К – электрохимический эквивалент (г/Кулон),
Q – количество прошедшего электричества (Кл).
Электрохимический эквивалент показывает массу образующегося вещества при пропускании 1Кл электричества.
К= 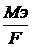
где Мэ – эквивалентная масса (моль/эквив),
F – число Фарадея (96500 Кл).
Q = I×t
где I – сила тока (Ампер),
t – время (сек).
m = 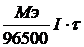
для газов: 
| II закон Фарадея | Одинаковые количества электричества выделяют при электролизе на электродах эквивалентные массы веществ. При этом для образования 1 эквивалента массы требуется 1 Фарадей электричества. m1 : m2 :…: mn = Э1 : Э2 : …: Эn где Э – химические эквиваленты веществ. |
Пример. Ток силой 3А проходя через раствор хлорида цинка за 60 минут выделяет из раствора 3,6г металла. Найти эквивалентную массу металла? Найти массу или объем выделившегося вещества на аноде?
Решение. Схему электролиза хлорида цинка мы записали выше. На катоде протекают совместно два процесса, восстановление воды и металла – цинка, но по условию задачи происходит восстановление цинка. На аноде идет окисление хлора с образованием газа, а следовательно расчет будем вести для объема выделяющегося газа – хлора.
Для расчета эквивалентной массы воспользуемсяI законом Фарадея mZn = 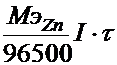 Þ
Þ 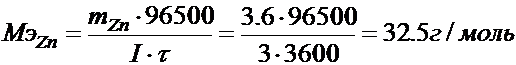
Для расчета объема газа выделившегося на аноде используем II закон Фарадея 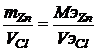 ,
, 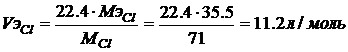 ,
, 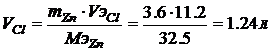
 2017-12-14
2017-12-14 1270
1270
