Закон збереження маси (М.В.Ломоносов 1748-1856 р., А.Лавуазье 1789 р.): в результаті хімічних перетворень сума мас речовин до реакції і сума мас речовин після реакції однакова.
Закон збереження енергії (М.В. Ломоносов): будь-яка енергія не зникає і не виникає, а тільки одні її види переходять в інші.
Закон сталості складу (Ж. Пруст, 1808 р.): кожна речовина має постійний якісний і кількісний склад незалежно від способів її одержання. Речовини, що отримані різними способами, але які мають той самий якісний і кількісний склад, повинні мати однакові хімічні властивості.
Закон кратних відношень (Д. Дальтон, 1803 р.): якщо два елементи утворюють один з одним кілька хімічних сполук, то маси одного елемента, що приходяться на ту саму масу іншого елемента, відносяться між собою як невеликі цілі числа. Застосовують до сполук, що утворюються з двох елементів. Наприклад, Карбон і Оксиген утворюють два оксиди: СО і СО2. У цих оксидах маси Оксигену, що приходяться на одну і ту ж масу Карбону, відносяться як 1:2.
Закон об ’ ємних відношень (Ж. Гей-Люссак, 1805-1808 р.): об’єми взаємодіючих газоподібних речовин відносяться між собою і до об’ємів продуктів реакції, як невеликі цілі числа.
Наприклад, 2NO + O2 = 2NO2; 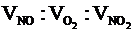 = 2: 1: 2.
= 2: 1: 2.
Закон Авогадро (А. Авогадро, 1811 р.): у рівних об’ємах різних газів за однакових умовах міститься однакове число часток (молекул, атомів, йонів). Наслідки:
1. Моль будь-якого газу при нормальних умовах займає об’єм 22,4 л.
2. Моль будь-якого газу при нормальних умовах містить 6,02 · 1023 часток (стала Авогадро NА).
Закон еквівалентів (Д.Дальтон, 1803 р.)
Еквівалент (Е) – масова кількість речовини, що взаємодіє з одним атомом чи йоном Гідрогену чи заміщає таку його кількість у хімічних реакціях. Еквівалент Гідрогену ЕН дорівнює одиниці. (ЕН = 1). Еквівалент Оксигену ЕО дорівнює восьми (ЕО = 8). Еквівалент елемента – величина змінна, що залежить від атомної маси (А) і валентності (В), що елемент має в конкретній сполуці:
 . (1.1)
. (1.1)
Наприклад, визначимо еквівалент Сульфуру в оксидах SO2 і SO3. У SO2: ЕS = 32/4 = 8, а в SO3: ЕS = 32/6 = 5,33.
Масу 1 моля еквівалентів речовини називають молярною масою еквівалентів речовини або еквівалентною масою (МЕ).
Молярні маси еквівалентів простих речовин розраховують за формулою:

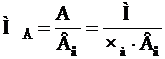 (г/моль), (1.2)
(г/моль), (1.2)
де  – валентність елемента;
– валентність елемента;  – число атомів елемента у молекулі.
– число атомів елемента у молекулі.
Молярна маса еквівалентів простої речовини дорівнює молярній масі еквівалентів хімічного елемента. Наприклад: МЕ(Н2) = 1 г/моль, МЕ(О2) = 8 г/моль.
 2017-12-16
2017-12-16 567
567








