Схема последовательной реакции:
 (65)
(65)
Пусть в начальный момент времени t=0 имеется а моль вещества А, а к моменту времени t вещества А осталось (а-х) моль и соответственно появилось (х – y) моль вещества В и y моль вещества С. Скорость превращения вещества А можно выразить уравнением:
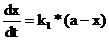 (66)
(66)
Интегрирование данного уравнения в пределах от 0 до t и от 0 до х приводит к выражению (сравнить с уравнением 13):
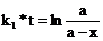 (67)
(67)
Отсюда
 (68)
(68)
Скорость превращения вещества В и С описывается уравнением:
 (69)
(69)
Подставляя значение х из (68) в (69) получим:
 (70)
(70)
Интегрирование уравнения (56) в пределах от 0 до t и 0 до y даёт:
 (71)
(71)
Пояснения (решение дифференциального уравнения (70)):
Уравнение (70) является линейным уравнением вида:

Уравнения подобного типа сводятся к двум уравнениям с разделяющимися переменными путём следующего искусственного приёма (демонстрация метода будет производиться как раз на решении уравнения (70)).
Запишем функцию y в виде произведения двух функций:
 (72)
(72)
Из данного равенства находим производную y’:
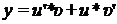 (73)
(73)
Подставляя эту замену в уравнение (70), получаем:
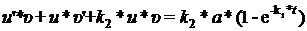
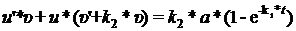 (74)
(74)
Выберем в качестве υ какое-нибудь частное решение уравнения:
 (75)
(75)
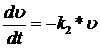
Интегрируя последнее уравнение, получим:
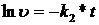
 (76)
(76)
Подставляем выражение (76) в (74), с учётом (75) имеем:

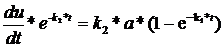

Интегрированием в пределах от 0 до t и от 0 до u получаем:
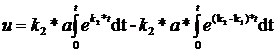

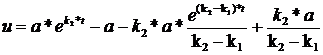
 (77)
(77)
Подставляем выражение (77) и (76) в (72):

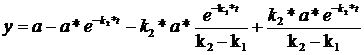
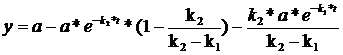
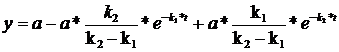
 (78)
(78)
Таким образом, (78) является решением уравнения (70), как записано в (71).
Вычитая уравнение (57) из (54’), получим:
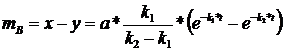 (79)
(79)
Если к1 << к2, то лимитирующей является первая стадия реакции, а во второй стадии реакции успевает установиться состояние, практически не отличающееся от равновесного:
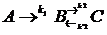
Пусть к моменту времени t протекания реакции прореагировало x молей вещества А. Тогда
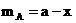 (80)
(80)
Уравнение для скорости первой лимитирующей стадии имеет вид
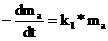 ;
; 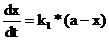 (81)
(81)
Разделив переменные и проинтегрировав уравнение в пределах от 0 до t и от 0 до х, получим:
 (82)
(82)
 (83)
(83)
Константу равновесия второй стадии К2 реакции можно представить уравнением
 (84)
(84)
Из (84) получаем
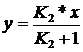 (85)
(85)
 (86)
(86)
Подставляя уравнение (83) в (85) и (86), находим
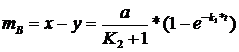 (87)
(87)
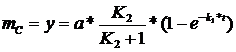 (88)
(88)
Если к1 >> к2, то лимитирующей является вторая стадия, которую считаем практически односторонней, а в первой стадии реакции успевает установиться состояние, которое практически не отличается от равновесного:
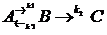
Полагаем, что в начальный момент времени t = 0 в равновесии находятся а молей вещества и b молей вещества В. При этом:
 ;
; 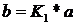 (89)
(89)
Пусть к моменту времени t прореагировало х молей вещества А, тогда:
 (90)
(90)
Поскольку в первой стадии сохраняется состояние, практически не отличающееся от равновесного, то
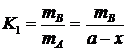 ;
; 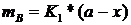 (91)
(91)
К моменту времени t х молей А превратилось в х молей В. За это же время у молей В превратилось в y=mC молей С, т. е. количества вещества В в момент времени t равно b+x-y. Поскольку равновесие в первой стадии между веществами А и В при протекании реакции практически не нарушится, можно написать, с учётом (89):
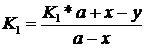 (92)
(92)
После элементарных преобразований:
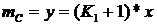 (93)
(93)
Кинетика лимитирующей (второй) стадии определяет закономерность протекания всего процесса. Учитывая, что вторая стадия представляет собой одностороннюю реакцию первого порядка, получим:
 (94)
(94)
 (95)
(95)
Сократив на  , разделив переменные и проинтегрировав в пределах от 0 до t и от 0 до x, получим:
, разделив переменные и проинтегрировав в пределах от 0 до t и от 0 до x, получим:
 (96)
(96)
 (97)
(97)
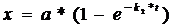 (98)
(98)
На основании уравнений (96), (97) и (90) можно написать
 (99)
(99)
Из (93) и (98) получаем:
 (100)
(100)
 2018-01-08
2018-01-08 284
284







