Зависимость скорости коррозии от внутренних и внешних факторов
Скорость коррозии определяется характером и свойствами самого металла, с одной стороны, и условиями коррозии, с другой.
Факторы, определяющие свойства металлов, называются внутренними факторами коррозии; факторы, определяющие свойства агрессивной среды и условия протекания коррозионного процесса – внешними факторами коррозии.
К внутренним факторам относятся свойства и состояние металла: электрохимический потенциал, структура, термическая и механическая обработка, наличие внутренних напряжений и др. К внешним факторам – природа, состав и концентрация агрессивной среды, температура, давление, скорость движения потока и др.
Рассмотрим некоторые основные внутренние и внешние факторы коррозии.
Влияние концентрации водородных ионов
Из разнообразных внешних факторов, влияющих на процессы электрохимической коррозии, одним из наиболее важных является концентрация водородных ионов (кислотность среды).
|
|
|
Влияние концентрации водородных ионов на коррозию может быть двояким.
а) Непосредственное влияние рН среды на электродный процесс.
На анодный процесс ионизации металла изменение рН – раствора практически не влияет, так как в анодной реакции не участвуют ионы Н+ и ОН–.
Влияние рН раствора на электродные процессы сказывается, в основном, при реакциях, протекающих на катодных участках. С уменьшением значения рН, потенциал водородного электрода делается положительнее и катодные процессы деполяризации облегчаются, в особенности, контролируемые процессом выделения водорода. Следовательно, при повышении концентрации водородных ионов скорость коррозии в растворах кислот возрастает. Однако это справедливо лишь для неокислительных кислот, например НCl. При увеличении концентрации соляной кислоты скорость растворения железа, цинка и ряда других металлов возрастает. В окислительных кислотах, наоборот, повышение концентрации кислоты может привести к уменьшению скорости коррозии в результате образования защитных оксидных пленок. Такое явление носит название пассивности и имеет место, например, при погружении железа или алюминия в концентрированную азотную кислоту. Если катодным процессом является не водородная или кислородная деполяризация, то влияние рН будет иметь место в том случае, если в реакцию катодного процесса входят ионы Н+ и ОН–, например
Н2О2 + 2е  2ОН–.
2ОН–.
Очевидно, увеличение концентрации ОН– -ионов на катоде (увеличение рН) будет тормозить протекание деполяризации этой реакцией. Наоборот, величина рН не будет оказывать влияния, если катодный процесс не связан с Н+ и ОН–, как например при катодной реакции
|
|
|
Fe3+ + e  Fe2+.
Fe2+.
б) Влияние рН на растворимость продуктов коррозии и образование защитных пленок.
В этом отношении металлы можно разделить на несколько групп:
- металлы, оксиды которых растворимы как в кислотах, так и в щелочах, например Zn, Al, Pb, Sn. В этом случае в кислых растворах образуются ионы растворяемых металлов, в то время как в щелочных растворах образуются комплексные ионы, в которых растворяемый металл уже не является катионом, но входит в комплексный анион ZnO22– - цинкат ион, AlO22– - алюминат ион.
Для первой группы металлов следует ожидать увеличения коррозии как при увеличении рН, так и при уменьшении от некоторого характерного значения для каждого металла, как показано на рис. 25а.
 |
- металлы второй группы, окcиды которых хорошо растворимы в кислотах, но не растворимы в щелочах, например Ni, Cd, Fe, будут уменьшать свою коррозионную устойчивость с уменьшением рН и, наоборот, увеличивать свою устойчивость с повышением рН, как показано на рис.25б.
- металлы с полной коррозионной устойчивостью как в кислых, так и в щелочных средах: Pt, Ag, Ti имеют практически постоянную и низкую скорость коррозии при различных рН среды. (рис.25в).
Значения рН электролитов, определяющие минимальную коррозию для некоторых металлов приведены ниже.
Металлы Al Fe Zn Sn Pb
Значение рН для минимальной коррозии 6,5 14 11 8,5 8
Влияние состава и концентрации солей в растворе
В зависимости от характера – главным образом от аниона соли – изменение концентрации солей может влиять на скорость коррозии различно.
Увеличение концентрации окисляющих солей ведет к уменьшению скорости коррозии почти до ее полного прекращения при переходе в пассивное состояние.
Увеличение концентрации кислых или основных солей ведет к подкислению или подщелачиваию раствора, и их действие на коррозию в значительной мере будет определяться коррозионным поведением металла с изменением значения рН.
Водные растворы гидролизирующихся солей влияют на скорость коррозионного процесса в зависимости от того, уменьшают ли они рН раствора (CaCl2, MgCl2):
2MgCl2 + H2O  Mg2OСl2 + 2HCl,
Mg2OСl2 + 2HCl,
или увеличивают его (Na2CO3):
Na2CO3 + 2H2O ® 2NaOH + H2CO3.
С увеличением концентрации нейтральных солей, не имеющих окислительных или других замедляющих воздействиий (NaCl, KCl, Na2SO4), скорость коррозии вначале растет, а затем уменьшается. Увеличение скорости коррозии в определенном диапазоне концентрации их в растворе связано с увеличением электропроводности раствора (уменьшение омического сопротивления коррозионных пар), а главное – с увеличением концентрации ионов Cl– - активирующих анодный процесс.
Последующее понижение скорости коррозии объясняется влиянием возрастающей концентрации соли на уменьшение растворимости кислорода в растворе. Так как коррозия большинства металлов, в частности железа, идет в этих растворах с кислородной деполяризацией, то уменьшение растворимости кислорода ведет к понижению скорости коррозии.
Влияние скорости движения коррозионной среды
Зависимость скорости коррозии от скорости движения аэрированных растворов, не содержащих активаторов коррозии, имеет сложный характер, представленный на рис.26 а.
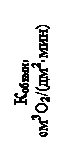


Такая сложная зависимость характерна для коррозионных процессов, лимитируемых диффузионной стадией. Влияние движения коррозионной среды в первую очередь сводится к изменению толщины диффузионного слоя, определяющего скорость массопереноса в приэлектродной зоне.
В начале с увеличением скорости движения раствора коррозия увеличивается по сравнению с неподвижным раствором в связи с усилением подвода кислорода к поверхности металла. Затем при некотором значении скорости движения раствора скорость коррозии замедляется в результате пассивации металла избыточным кислородом с образованием защитных пленок.
|
|
|
Дальнейшее увеличение скорости движения среды приводит опять к увеличению скорости коррозии, но уже вследствие механического удаления защитных пленок быстро движущимся потоком.
В некоторых условиях коррозии, например при наличии значительной концентрации активных анионов в растворе, когда явление пассивации затрудняется, снижение скорости коррозии может не наступать (второй участок), как это имеет место в морской воде при увеличении скорости ее движения.
Увеличение скорости движения среды способствует усилению влияния анионов-активаторов, в частности Cl–, на коррозию стали. Так, в растворе 1,3. 10-3 н NaCl, коррозия при больших скоростях течения электролита увеличивается в 10 – 100 раз.
При коррозии с водородной деполяризацией скорость движения потока сказывается в меньшей степени, чем при кислородной деполяризации.
В нефтеперерабатывающей и химической промышленности многие аппараты и оборудование работают в таких условиях, когда агрессивные жидкости циркулируют или перемешиваются с различной скоростью. Поэтому следует учитывать, что скорость коррозионного процесса в значительной степени зависит от скорости циркуляции агрессивного раствора.
Влияние температуры
С повышением температуры скорость коррозии в электролитах увеличивается. Увеличение скорости коррозии объясняется падением омического сопротивления электролитов при повышении температуры, возрастанием скорости диффузии, интенсификацией анодных и катодных процессов. Таким образом, все факторы изменяются в сторону усиления коррозионных пар.
При растворении металлов в неокислительных кислотах температурная зависимость скорости коррозии описывается уравнением Аррениуса
К = А . е–B/T, (38)
где А и В – постоянные;
е – основание натуральных логарифмов;
T – абсолютнаятемпература.
После логарифмирования это уравнение имеет вид:
ln K = ln A – B/T, (39)
|
|
|
то есть логарифм скорости коррозии изменяется линейно с величиной, обратной абсолютной температуре.
Для случаев коррозии с кислородной деполяризацией наблюдается более сложная зависимость изменения скорости коррозии с повышением температуры. С повышением температуры скорость коррозии в начале увеличивается за счет ускорения диффузии кислорода и уменьшения перенапряжения ионизации кислорода. Однако при дальнейшем повышении температуры скорость коррозии может снижаться. Это явление связано с уменьшением растворимости кислорода или появлением защитных свойств у продуктов коррозии.
Уменьшение скорости коррозии вследствие понижения концентрации кислорода в растворе особенно характерно для коррозии железа в воде в открытой системе. Вода в открытой системе при комнатной температуре содержит в 1 л. около 6 см3 растворенного кислорода, а при 98оС – около 0,2 см3/л; содержание же кислорода в воде, находящейся в закрытой системе, практически не меняется. Вследствие этого скорость коррозии железа в воде изменяется при повышении температуры различно в зависимости от того, закрыта или открыта система.
Как видно из рис.27, в первом случае при повышении температуры скорость коррозии непрерывно увеличивается. Во втором случае до 80оС наблюдается усиление коррозии, но при более высокой температуре, вследствие уменьшения содержания кислорода в растворе, скорость коррозии уменьшается.


Помимо прямого влияния температуры установленным является факт влияния теплопередачи на коррозию металлов как в активном, так и пассивном состояниях. Действие тепловых потоков на скорость коррозии металлов является сложным и определяется природой коррозионной системы. Передача тепла от металла к раствору или в обратном направлении не просто изменяет температуру в коррозионной зоне, но влияет на массоперенос в жидкости, а в связи с этим на механизм и кинетические закономерности коррозионного процесса и состав фазовой границы.
Причиной интенсификации коррозии в неизотермических условиях считается повышение концентрации кислорода у корродирующей поверхности, омываемой более холодной жидкостью.
При кинетическом контроле в кислой среде теплопередача от жидкости к металлу усиливает коррозию металла, а при обратном направлении теплового потока – уменьшает. Приведенные эффекты объясняются влиянием теплопереноса на структуру и состав двойного электрического слоя, а также на механизм процесса. Например, в растворе 1N Na2SO4 (рН=2) изменяется порядок реакции по гидроксил- и сульфат-ионам. При тепловой нагрузке 19 – 58 кВт/м2 теплопередача приводит к усилению коррозии углеродистой стали в водных растворах при любом характере деполяризации – водородной и кислородной.
Увеличение скорости коррозии на 2 – 3 порядка при теплопередаче наблюдается при неполном погружении в раствор за счет усиления процессов испарения – конденсации и появления зон повышенной коррозионной агрессивности в системе “металл-раствор”.
На коррозионном поведении неизотермических систем может проявляться термогальваническая коррозия из-за наличия температурного градиента по сечению металла.
Кроме того, на теплопередающей поверхности интенсифицируются процессы кристаллизации трудно растворимых солевых систем из-за изменения физико-химических свойств растворенных в воде компонентов. Самым распространенным видом солеотложения является карбонат кальция из-за взаимных превращений диссоциированных форм карбонатно-кальциевой основы воды. Повышение температуры, теплопередача, солеотложения способствуют развитию неравномерной, как правило, язвенной коррозии.
Влияние давления
В нефтеперерабатывающей промышленности многие процессы осуществляются при высоких давлениях или больших напряжениях. Основной причиной влияния давления на процессы электрохимической коррозии является изменение растворимости газов или появление механических напряжений в металле. Повышение давления особенно сказывается на усилении коррозии при протекании процессов с кислородной деполяризацией и в связи с облегчением процесса гидролиза многих солей. Повышение давления и температуры резко усиливает также скорость газовой коррозии, как это имеет место при воздействии водорода.
 2018-01-08
2018-01-08 1465
1465






