Английский ученый Резерфорд, пропуская альфа-частицы с большой кинетической энергией через тонкие металлические пластинки, установил, что большая часть частиц отклоняются от первоначального направления на небольшие углы. Наряду с рассеиванием на малые углы, было обнаружено отклонение отдельных частиц и на большие углы, доходящие до 1800 (Рис.1). Такое рассеивание было обнаружено и при прохождении альфа-частиц через газы.
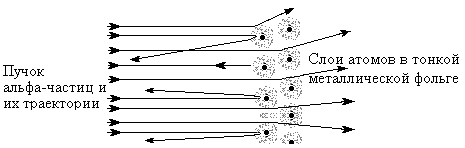
Рис.1. Схема опытов Резерфорда.
При анализе этих экспериментов было установлено, что отклонения происходят вследствие кулоновского отталкивания от положительного заряда, сосредоточенного в очень малом объеме внутри атома. До этого уже было известно (по экспериментам с ионизацией газов), что в составе атомов вещества также имеются элементарные частицы – электроны (с малой массой и отрицательным зарядом). Для объяснения результатов рассеивания Резерфорд в 1911г. предложил планетарную модель атома. Согласно этой модели атом построен по типу Солнечной системы - в центре атома в очень малой области (10-14 м) находится положительно заряженное ядро, в котором сосредоточена почти вся масса атома, а вокруг ядра под действием сил Кулоновского притяжения двигаются по замкнутым орбитам электроны (примерный радиус орбит -10-10м). При этом суммарный заряд электронов равен по величине заряду ядра, поэтому в целом атом нейтрален. При прохождении альфа-частиц через такой атом, только малая часть частиц будет сталкиваться с ядром и рассеиваться назад, основная их часть будет проходить на больших расстояниях от ядра и, вследствие малости Кулоновских сил, будут отклоняться на небольшие углы.
Таким образом, планетарная модель атома полностью объяснила эксперименты по рассеиванию. Однако, согласно классической электродинамике электрон, двигающийся по орбите вокруг ядра должен испускать электромагнитные волны непрерывного спектра частот. При этом он теряет свою энергию и через малый интервал времени (10-8 с) должен упасть на ядро, то есть такой атом нестабилен и имеет очень малое время жизни. Но, как известно, атомы отличаются большим временем жизни. Кроме того, из экспериментов по изучению частотного состава излучения (спектров) отдельных атомов в газах, известно, что атомы в невозбужденном (нормальном) состоянии не испускают электромагнитные волны, они излучают их только после передачи им энергии (при возбуждении), при зтом спектр частот имеет дискретный характер. Например, у атома водорода было обнаружено несколько серий частот излучения, наиболее известные описываются соотношениями:
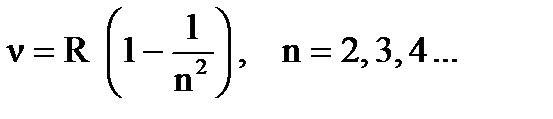 (1.1)
(1.1)
серия Лаймана для ультрафиолетового излучения,
 (1.2)
(1.2)
 2018-01-08
2018-01-08 888
888








